Trong chương trình Hóa học lớp 8, chúng ta đã bắt đầu làm quen với các ký hiệu hóa học, tên viết tắt của các nguyên tố hóa học. Vậy N là gì trong Hóa học? Cùng GiaiNgo tìm hiểu ngay nhé!
Nội dung chính
N là gì trong Hóa học?
N là gì trong Hoá học?
N là ký hiệu của nguyên tố Nitơ. Đây là một nguyên tố trong bảng tuần hoàn những nguyên tố Hóa học. N có số nguyên tử bằng 7 và nguyên tử khối bằng 14 .
Ở điều kiện kèm theo thường, Nitơ sống sót dưới dạng phân tử N2, còn gọi là đạm khí. Nitơ là một chất khí không màu, không mùi, không vị .

Ngoài ra, ký hiệu N trong Hóa học lớp 10 còn là tổng số hạt notron của hạt nhân. Ví dụ, hạt nhân Nhôm ( Al ) có số notron ( N ) là 14 .
N được dùng trong công thức tính số khối của hạt nhân nguyên tử :
A = Z + N
Trong đó:
- A: Số khối
- Z: Số proton
- N: Số notron
Như vậy bạn đã có câu vấn đáp cho câu hỏi N là gì trong Hóa học. Vậy n là gì trong Hóa học ? Cùng GiaiNgo tìm hiểu và khám phá trong phần tiếp theo nhé !
n là gì trong Hoá học?
n là ký hiệu của số mol. Mol là đơn vị chức năng đo lường và thống kê dùng diễn đạt lượng chất có chứa giao động 6,022 nhân 10 mũ 23 số hạt đơn vị chức năng nguyên tử hoặc phân tử chất đó .
Con số này được gọi là số Avogađro và được kí hiệu là N. Ví dụ, 1 mol nguyên tử sắt là một lượng sắt có chứa N nguyên tử Fe .
Mol cũng được sử dụng để bộc lộ lượng chất phản ứng và mẫu sản phẩm của những phản ứng hóa học. Cụ thể, khi hydro ( H2 ) tính năng với oxy ( O2 ) sẽ tạo ra nước ( H2O ) .
PTHH : 2 H2 + O2 → 2 H2O
Từ phương trình ta hoàn toàn có thể hiểu là 2 mol hydro và 1 mol oxy phản ứng tạo thành 2 mol nước .
Các ký hiệu trong công thức Hoá học
Không chỉ tìm hiểu và khám phá N là gì trong Hóa học, GiaiNgo còn trình làng đến bạn một số ít ký hiệu trong những công thức hóa học. Mời bạn đọc tìm hiểu thêm nhé !
Công thức tính số mol
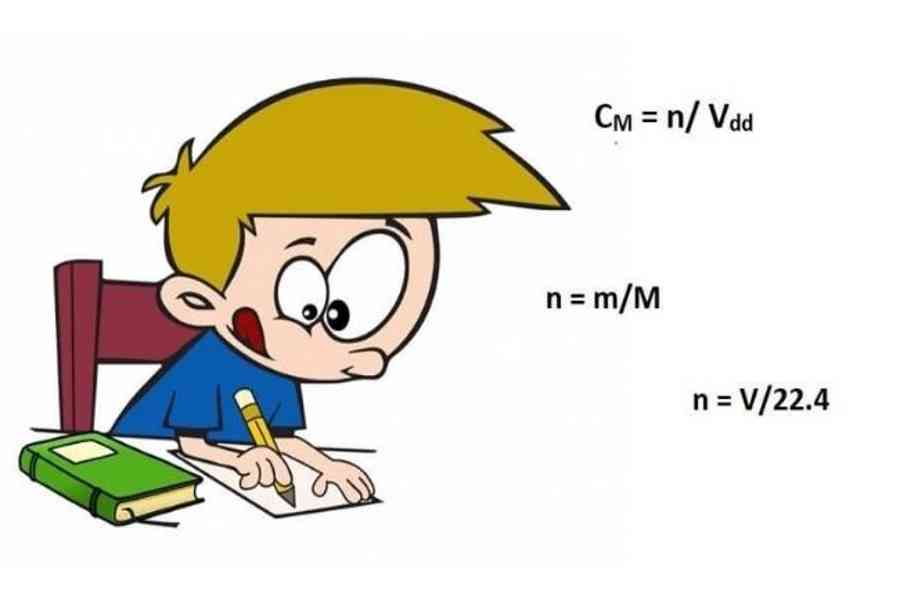
n = m/M
n = CM x V
Trong đó :
- n: Số mol chất.
- m: Khối lượng chất.
- M: Khối lượng mol chất.
- CM: Nồng độ mol.
- V: Thể tích dung dịch.
Công thức tính thế tích mol khí
Thể tích mol không đổi khi những điều kiện kèm theo nhiệt độ và áp suất không đổi. Do đó, ở điều kiện kèm theo tiêu chuẩn thì 1 mol khí có thể tích là 22,4 lít ) .
V = n x 22,4
Trong đó:
- V: Thể tích mol khí.
- n: số mol.
Công thức tính nồng độ mol
Nồng độ mol cho tất cả chúng ta biết số lượng mol chất tan sống sót trong dung dịch .
Công thức tính như sau :
CM = n/V
Trong đó ,
- CM: Nồng độ mol.
- n: Số mol chất tan.
- V: Thể tích dung dịch.
Ngoài ra, để tính được nồng độ mol, bạn hoàn toàn có thể sử dụng công thức sau :
CM = (10 x D x C%)/M
Trong đó :
- M là khối lượng mol.
- C% là nồng độ phần trăm.
- D là khối lượng riêng (đơn vị gam/ml).
Để củng cố kiến thức và kỹ năng N là gì trong Hóa học, tất cả chúng ta cùng làm 1 số ít bài tập nhé !
Bài tập minh họa
Bài 1: Tính số mol nguyên tử hoặc phân tử trong những lượng chất sau:
a. Số mol NaOH trong 20 gam NaOH .
b. 2,24 lít khí C2H4 ; 3,36 lít khí CO2 ; 10,08 lít khí N2. Các thể tích đo ở điều kiện kèm theo tiêu chuẩn .
Hướng dẫn giải:
a. Số mol NaOH trong 20 gam NaOH là :
nNaOH = m / M = 20/40 = 0,5 ( mol ) .
b. Áp dụng công thức tính số mol : n = V / 22,4 ta có :
Số mol của 2,24 lít khí C2H4 là : nC2H4 = 2,24 / 22,4 = 0,1 ( mol ) .
Số mol của 3,36 lít khí CO2 là : nCO2 = 3,36 / 22,4 = 0,15 ( mol ) .
Số mol của 10,08 lít khí N2 là : nN2 = 10,08 / 22,4 = 0,45 ( mol ) .
Bài 2: Tính nồng độ mol của dung dịch khi hòa tan 15,8g KMnO4 trong 5 lít nước.
Hướng dẫn giải:
Số mol của KMnO4 là : nKMnO4 = m / M = 15,8 / 158 = 0,1 ( mol ) .
Nồng độ mol của dung dịch : CM = n / V = 0,1 / 5 = 0,02 ( M ) .
Hy vọng những kiến thức và kỹ năng về Hóa học mà GiaiNgo đã san sẻ hoàn toàn có thể giúp bạn nắm được N là gì trong Hóa học cũng như những công thức hóa học tương quan. Hãy đón đọc những bài viết tiếp theo của GiaiNgo để làm giàu thêm vốn kỹ năng và kiến thức của mình nhé !
Source: http://139.180.218.5
Category: Thuật ngữ đời thường