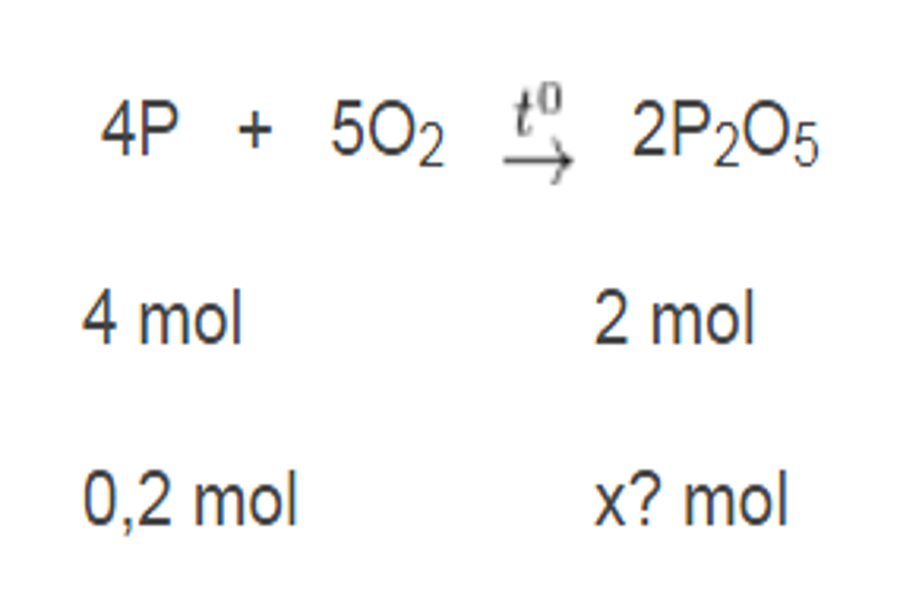Nội dung chính
Công thức tam suất là gì? Quy tắc tam suất trong hóa học?
Công thức tam suất là gì? Quy tắc tam suất trong hóa học, toán học có ý nghĩa như nào? Hãy cùng tìm hiểu qua bài viết này, chúng tôi sẽ giải đáp những thắc mắc trên giúp bạn và đưa ra các dạng bài tập về công thức tam suất để bạn hiểu rõ hơn!
Tìm hiểu quy tắc tam suất là gì?
Công thức tam suất là gì? Hãy cùng đi tìm hiểu định nghĩa qua những thông tin dưới đây để hiểu rõ được bản chất:
Định nghĩa quy tắc tam suất là gì?
Trong toán tiểu học, có dạng bài toán đại lượng tỉ lệ (gồm hai dạng tỉ lệ thuận và tỉ lệ nghịch) những bài toán đó được gọi là bài toán giải theo quy tắc tam suất.
- Công thức tam suất thuận cũng hoàn toàn có thể hiểu đơn thuần là quy tắc nhân chéo chia ngang .
- Trong hóa học, những bài toán tính theo công thức và phương trình hóa học khi chỉ biết lượng của một trong những chất phản ứng hoặc chất mới sinh ra trong phản ứng là hoàn toàn có thể tính được lượng của chất còn lại ( lượng những chất hoàn toàn có thể tính theo mol, theo khối lượng là gam, kilogam, tấn hoặc theo thể tích là ml hoặc lít hoặc mét khối ) đều được tính theo cách lập quy tắc tam suất .
Đại lượng tỉ lệ thuận là gì?
- Hai đại lượng tỉ lệ thuận được hiểu là khi đại lượng này tăng ( hoặc giảm ) bao nhiêu lần thì đại lượng kia cũng tăng ( hoặc giảm ) bấy nhiêu lần .
- Công thức tam suất thuận là nhân chéo chia ngang .
Đại lượng tỉ lệ nghịch là gì?
- Hai đại lượng tỉ lệ nghịch được hiểu là khi đại lượng này tăng bao nhiêu lần thì đại lượng giảm bấy nhiêu lần .
- Công thức tam suất nghịch là nhân ngang chia dưới .
Tìm hiểu về công thức tam suất
Dưới đây là một số ít ví dụ để bạn hiểu rõ về công thức tam suất trong hóa học
Ví dụ công thức tam suất
Ví dụ:
Cho 3 mol NaOH tính năng vừa đủ với HCl. Tìm số mol của NaCl .
Cách giải
Ta có :
NaOH + HCl ( rightarrow ) NaCl + ( H_ { 2 } O )
Theo pt 1 1 1 1 ( mol )
Theo bài 3 ? ( mol )
Áp dụng quy tắc tam suất ta có :
( n_ { NaCl } = frac { 3.1 } { 1 } = 3, ( mol ) )Chú ý: Phần tỷ lệ mol có thể giữ nguyên, còn phần phía dưới có thể không phải là số mol, loại này sử dụng cho tất cả các đơn vị (V, kg ,…)
Công thức tam suất tổng quát
Từ ví dụ trên ta hoàn toàn có thể rút ra công thức tổng quát như sau :
Nếu ( frac { a } { b } = frac { c } { d } Leftrightarrow ad = bc )
Muốn tìm d ta lấy ( ( c. b ) : a )
Bài tập về quy tắc tam suất thường gặp
Cùng than khảo 1 số ít dạng bài tập về quy tắc tam suất thường gặp giúp bạn hiểu rõ hơn cũng như làm bài tốt hơn
Dạng 1: Tính khối lượng, thể tích chất tham gia hoặc chất sản phẩm được tạo thành
Phương pháp giải :
- Bước 1:Tìm số mol chất đề bài cho bằng công thức ( n = frac { n } { M } ) hoặc ( n = frac { V } { 22,4 } )
- Bước 2:Lập phương trình hóa học
- Bước 3:
Áp dụng công thức tam suất để tính ra số mol chất cần tìm
- Bước 4:Chuyển đổi ra khối lượng hoặc thể tích tùy theo nhu yếu của đề bài .
Ví dụ 1: Cho 5,4 gam Al tác dụng với axit sunfuric thu được muối và khí bay ra. Xác định khối lượng muối thu được
Cách giải
Ta có :
( n_ { Al } = frac { 5,4 } { 27 } = 0,2, ( mol ) )
Phương trình phản ứng :
( begin { matrix } 2A l + 3H _ { 2 } SO_ { 4 } rightarrow Al_ { 2 } ( SO_ { 4 } ) _ { 3 } + 3H _ { 2 }, ,, ,, ,, ,, ,, ,, , 2, ( mol ), ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, 1, ( mol ), ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, 0,2, ( mol ), ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, 0,1, ( mol ), ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, ,, end { matrix } )
Áp dụng quy tắc tam suất ta có :
( n_ { Al_ { 2 } ( SO_ { 4 } ) _ { 3 } } = frac { 0,2. 1 } { 2 } = 0,1, ( mol ) )
( Rightarrow m_ { Al_ { 2 } ( SO_ { 4 } ) _ { 3 } } = 0,1. 342 = 34,2, ( gam ) )
Dạng 2: Tìm chất dư trong phản ứng
Phương pháp giải
Xem thêm: Cách chứng minh đường trung trực lớp 7
Giả sử phương trình phản ứng là : ( aA + bB rightarrow cC + dD )
- Bước 1: Lập tỷ suất ( frac { n_ { A } } { a } ) và ( frac { n_ { B } } { b } ), trong đó
( n_ { A } ) và ( n_ { B } ) lần lượt là số mol chất A và chất B theo đề bài .
- Bước 2:So sánh tỷ số :
- Nếu ( frac { n_ { A } } { a } > frac { n_ { B } } { b } ) thì chất B hết, chất A dư .
- ( frac { n_ { A } } { a }
- Bước 3:Tính những lượng chất theo chất phản ứng hết
Ví dụ 2: Đốt cháy 6,2 gam photpho trong bình chứa 6,72 lít khí oxi ở đktc. Hãy cho biết sau khi cháy
- Photpho hay oxi chất nào còn dư ?
- Chất nào được tạo thành và khối lượng là bao nhiêu gam ?
Cách giải
- Ta có :
( n_ { P } = 0,2, ( mol ) )
( n_ { O } = 0,3, ( mol ) )
Phương trình phản ứng :
( 4P + 5O _ { 2 } rightarrow 2P _ { 2 } O_ { 5 } )
Lập tỷ suất ( frac { 0,2 } { 4 } = 0,5

Áp dụng công thức tam suất ( Rightarrow x = frac { 0,2. 2 } { 4 } = 0,1, ( mol ) )
Vậy khối lượng ( P_ { 2 } O_ { 5 } ) là : ( m_ { P_ { 2 } O_ { 5 } } = 0,1. 142 = 14,2, ( gam ) )
Dạng 3: Tính hiệu suất phản ứng
Hiệu suất của phản ứng được tính theo một trong 2 cách sau :
- Cách 1: H % = ( frac { KLSPTT } { KLSPLT }. 100 ) %
- Trong đó :
KLSPTT là khối lượng sản phẩm thực tế.
KLSPLT là khối lượng sản phẩm lý thuyết.
- Cách 2:H % = ( frac { KLCTGTT } { KLCTGLT }. 100 ) %
- Trong đó:
KLCTGTT là khối lượng chất tham gia thực tế.
KLCTGLT là khối lượng chất tham gia lý thuyết.
***Lưu ý:
- Khối lượng trong thực tiễn là khối lượng đề bài cho .
- Khối lượng kim chỉ nan là khối lượng tính theo phương trình .
Ví dụ 3: Nung 150 kg (CaCO_{3}) thu được 67,2 kg CaO. Tính hiệu suất phản ứng.
Cách giải
Phương trình phản ứng :
Khối lượng CaO thu được theo triết lý là
(x = frac{150.56}{100} = 84, (kg))
Xem thêm: Tam giác.
Hiệu suất phản ứng là :
H % = ( frac { 67,2 } { 84 }. 100 ) % = 80 %
Như vậy, bài viết trên đây đã giúp bạn tổng hợp lý thuyết và những dạng bài tập về công thức tam suất. Hi vọng đã giúp bạn tiếp thu và bổ trợ kiến thức hóa học có ích về công thức tam suất .
Source: http://139.180.218.5
Category: tản mạn