ĐẶT VẤN ĐỀ
Khối tân sinh thần kinh nội tiết đường tiêu hóa ( Gastrointestinal neuroendocrine neoplasms – GI NENs ) bắt nguồn từ tế bào thần kinh nội tiết nằm tại vùng niêm mạc và dưới niêm mạc của ống tiêu hóa .
Mặc dù những phương tiên chẩn đoán hình ảnh tích hợp công dụng đang ngày càng tăng trưởng, giải phẫu bệnh vẫn đóng vai trò quan trọng trong quy trình chẩn đoán ỤTNTĐTH. Chính do đó, Tổ chức Y tế quốc tế đã đưa ra một phân loại dành cho UTKNT mới vào năm 2010 và update năm 2017, đa phần dựa trên những tài liệu mô bệnh học như chỉ số Ki-67 và chỉ số phân loại ( mitotic count ) .
Trong bài viết này, chúng tôi xin đề cập tới khía cạnh mô bệnh học của nhóm bệnh lý u này; bao gồm phân độ và giai đoạn bệnh, sinh thiết và chẩn đoán tế bào học, chất chỉ điểm sinh học, khía cạnh di truyền và sinh học phân tử, cuối cùng là đặc điểm mô bệnh học riêng theo cơ quan.
MÔ BỆNH HỌC CỦA U THẦN KINH NỘI TIẾT ĐƯỜNG TIÊU HÓA (UTKNTĐTH)
CÁC ĐẶC ĐIỂM CHUNG
Mặc dù đặc thù mô bệnh học cửa UTKNTĐTH phụ thuộc vào vị trí giải phẫu cũng như nguồn gốc tế bào nội tiết, vẫn có những đặc thù mô bệnh học chung so với nhóm bệnh lý này. Về đại thể, UTKNT có dạng trắng đến vàng ngà hoặc xám, với dạng nốt hoặc dạng đa polyp ( Hình 1 ). Niêm mạc bên trên thường nguyên vẹn hoặc có loét nhỏ bởi hầu hết UTKNT typ G1 và G2 nằm sau dưới lớp niêm mạc và dưới niêm mạc. Ngược lại, ung thư thần kinh nội tiết ( UTTKNT ) thường có dạng loét lớn giống như ung thư biểu mô nổi bật ( Hình 2 ) ,

Về vi thể, UTKNT tuýp G1 và G2 gồm có những tế bào u nhân tròn hoặc bầu dục, với chất nhiễm sắc dạng hạt cùng những túi tế bào chất ái toan. Tổ chức u tạo thành những cấu trúc dạng dải, dạng khuôn hẹp hoặc khuôn hình giấy. UTTKNT chia làm nhóm tế bào lớn và tế bào nhỏ. Dạng tế bào nhỏ gồm có những tế bào khối u nhỏ, tròn, hình trứng hoặc hình thoi với ít tế bào chất ; chúng đa phần được sắp xếp theo quy mô giống như tấm giấy. Hạt nhân của tuýp tế bào nhỏ cho thấy chất nhiễm sắc dạng hạt mịn với sự vắng mặt của hạt nhiễm sắc vắng mặt. Dạng tế bào lớn là gồm có những tế bào khối u có kích cỡ trung bình hoặc lớn với nhân không nổi bật và hạt nhiễm sắc rõ ràng. Tỷ lệ nhân trên tế bào chất ở nhóm này thấp hơn so với nhóm tế bào nhỏ. MANECs là những khối u ác tính gồm có cả ung thư biểu mô tuyến và những thành phần ung thư biểu mô nội tiết thần kinh, với mỗi thành phần chiếm hơn 30 % thể tích khối u. Ung thư biểu mô tế bào vảy cùng sống sót với NECs cũng được báo cáo giải trình Open ở thực quản và tá tràng .
Phân Loại ( Grading ) Và Phân Độ ( Staging ) Của UTKNTĐTH
Bảng 1: so sánh phân loại của WHO cho UTKNT năm 2010 và 2017
Theo phân độ của WHO năm 2010, UTKNT đường tiêu hóa được chia thành UTKNT typ G1, G2, UTTKNT hay UTKNT typ G3 ( nhóm tế bào nhỏ và nhóm tế bào lớn ) và MANEC [ 1 ]. Theo phân loại này, khái niệm UTTKNT và UTKNT typ G3 là tương tự nhau, mặc dầu việc này không được khuyến nghị do thực chất của UTKNT là nhóm tế bào biệt hóa cao. Phân loại của WHO dựa trên chỉ số Ki-67 và chỉ số nhân chia trên mô bệnh. Phân loại mới năm 2017 của WHO có 1 số ít đổi khác so với phân loại cũ ( Bảng 1 ). Theo đó, phân loại này định nghĩa lại khái niệm UTKNT typ G3 và UTTKNT, và nhóm ung thư hỗn hợp TKNT-biểu mô tuyến được sửa chữa thay thế bởi nhóm u tân sinh thần kinh nội tiết và những thành phần [ 2 ] .
Theo những nghiên cứu và điều tra gần đây, ung thư thần kinh nội tiết gồm có hai dạng không như nhau là dạng biệt hóa cao và dạng biệt hóa thấp. Dạng biệt hóa cao có chỉ số Ki-67 Phân độ mới nhất của hiệp hôi Ung thư học Hoa Kỳ ( American Joint Committee on Cancer – AJCC ) được triển khai trên từng bộ phận. Mục số 2 sẽ đề cập đến sự độc lạ này, cũng như đặc thù riêng về mô bệnh học của UTKNT từng cơ quan, gồm có : tụy, dạ dày, tá tràng và bóng Vater, hỗng hồi tràng, ruột thừa và đại trực tràng [ 9 ] .
Bảng 2: So sánh phân độ giai đoạn T của ENETS và UICC đối với UTKNT dạ dày
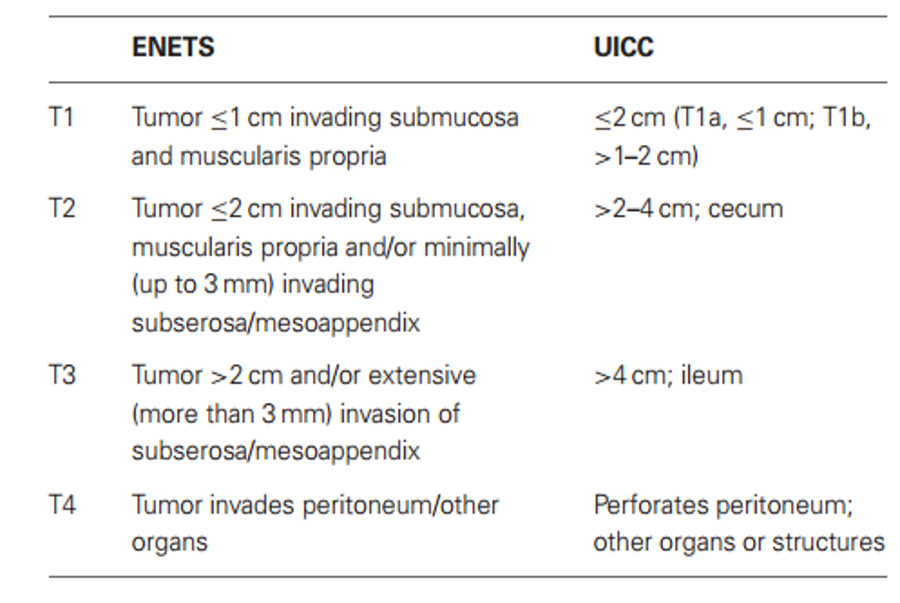
Bảng 3: So sánh phân độ giai đoạn T của ENETS và UICC đối với UTKNT ruột thừa
Hóa Mô Miễn Dịch – Các Chất Chỉ Điểm Nội Tiết ( Neuroendocrine Markers )
Một số chất chỉ điểm của UTKNT đã được biết đến : chromogranin, synaptophysin, protein 9.5, phân tử gắn mặt phẳng tế bào nội tiết ( NCAM / CD56 ), enolase thần kinh, và Leu 7. Trong đó Chromogranin A và Synaptophysin là 2 chất chỉ điểm u phổ cập nhất để chứng minh và khẳng định đặc thù nột tiết của những tế bào u .
Chromogranin A là một trong những protein dạng acid thuộc hệ chromogranin / secretogranin, được tìm thấy trong những túi tiết của tế bào thần kinh nội tiết [ 10 ]. Mặc dù là một chất chỉ điểm UTKNT quan trọng, Chromogranin A nhiều lúc biểu lộ âm tính so với những dạng UTKNT mà những tế bào chứa ít túi tiết [ 10 ]. Tương tự, so với UTTKNT, sự biểu lộ của Chromogranin A thường yếu và không tuyệt đối [ 11 ]. Bên cạnh đó, với UTKNT đoạn ruột sau, mức độ biểu lộ của Chromogranin A cũng thường yếu hơn, mà ở đây thường biểu lộ Chromogranin B [ 10 ]. Synaptophysin là một thành phần của những túi synap và thường xuất hiện ở những tế bào thần kinh và thần kinh nội tiết. Không như Chromogranin A, Synaptophysin thường bộc lộ mạnh với những nhóm UTKNT độ ác tính cao [ 8 ] .
Marker hóa mô miễn dịch đặc trưng theo cơ quan: CDX2, PAX8, PDX1, ISL-1. Trong những trường hợp di căn gan, điều quan trọng là cần tìm được vị trí tổn thương nguyên phát. Đôi khi, triệu chứng cơ năng, lâm sàng, chẩn đoán hình ảnh không thể giúp ta chẩn đoán chính xác vị trí u nguyên phát, một số chất chỉ điểm hóa mô miễn dịch có thể được sử dụng. Tổng hợp từ nhiều nghiên cứu cho thấy, các chất chỉ điểm miễn dịch như Thyroid transcription factor 1 (TTF1), Caudal Type Homeobox 2 (CDX2), ISL LIM Homeobox 1 (ISL-1), Pax8, và pancreatic and duodenal homeobox 1 (PDX1) có thể được sử dụng phục vụ mục tiêu này, nhằm phân biệt vị trí UTKNT biệt hóa cao nguồn gốc phổi, đường tiêu hóa và tụy (Bảng 4) [12], [13], [14], [15]
Bảng 4: Chất chỉ điểm miễn dịch đặc trưng theo cơ quan
Trong một nghiên cứu và điều tra khác của Yang và tập sự, với ba chất chỉ điểm miễn dịch là TTF1, CDX2 và ISL1, có độ nhạy lần lượt là 81 %, 89 %, và 63 %, độ đặc hiệu lần lượt là 100 %, 94 %, và 100 % trong việc phân nhóm UTKNT di căn gan thành 3 nhóm tổn thương nguyên phát : phổi, ruột non và tụy / trực tràng [ 16 ]. Gần đây, Yang và tập sự liên tục đưa ra NK2 homeobox 2 ( NKX2. 2 ), như một chất có vai xác lập vị trí tổn thương nguyên phát, theo đó, NKX2. 2 cho thấy độ nhạy cáo hơn CDX2 và PDX1 trong việc xác lập nguồn gốc của UTKNT biệt hóa cao nghiên cứu và phân tích trên 98 trường hợp [ 17 ] .
Sinh Thiết Mô Bệnh Học Và Tế Bào Học
Sinh thiết bằng clip kẹp nội soi thường khó khăn vất vả và tỷ suất chẩn đoán không cao, do hầu hết UTKNT nằm ở lớp niêm mạc và dưới niêm mạc, do size tổ chức triển khai sinh thiết không đủ và thực trạng vỡ u do quy trình thủ pháp [ 18 ]. Vì thế, cần tích hợp hóa mô miễn dịch trong chẩn đoán khởi đầu nhằm mục đích chẩn đoán đúng chuẩn phân loại và phân độ bệnh. Bên cạnh đó, hoàn toàn có thể sử dụng những chiêu thức sinh thiết khác như chọc hít bằng kim qua siêu âm nội soi ( Endoscopic ultrasound guided fine-needle aspiration ) [ 19 ] .
Mặc dù vậy, tính đúng mực của sinh thiết trong việc nhìn nhận phân độ bị ảnh hưởng tác động bởi tính không giống hệt của khối u [ 20 ]. Couverlard và tập sự điều tra và nghiên cứu tính như nhau của chỉ số Ki-67 bằng cách so sánh 2 mảnh sinh thiết di căn gan của những khối UTKNT tụy. Họ nhận thấy tính tương quan chặt về chỉ số Ki-67 giữa những vùng di căn ( thông số đối sánh tương quan nội 0.63 ) [ 21 ]. Mặc dù vậy, nghiên cứu và điều tra của Yang và tập sự cho thấy 50% những trường hợp di căn gan đều có đặc thù không giống hệt về phân độ ( G1 phối hợp với G2 ) [ 20 ] .
Một yếu tố khác đặt ra là với những thể hỗn hợp UTTKNT và ung thư biểu mô tuyến ( Mixed Adenoneuroendocrine Carcinoma – MANEC ) hay UTKNT chứa những thành phần khác, vị trí sinh thiết hoàn toàn có thể không chứa thành phần thần kinh nội tiết, từ đó gây ra việc chẩn đoán nhầm. Vì thế cần sinh thiết nhiều vị trí nhằm mục đích chẩn đoán đúng chuẩn thể bệnh [ 22 ] .
Di Truyền Học Và Khía Cạnh Phân Tử
Đột biến gen MEN1 ( 11 q13 ) gây ra hội chứng đa tăng sản thần kinh nột tiết tuýp 1. Tỷ lệ mất tính dị hợp tử ( loss of heterozygosity – LOH ) của gen MEN1 ở nhóm UTKNT hệ tiêu hóa là 39 % [ 23 ]. Tỷ lệ đột biến và methyl hóa chất xúc tác của gen MEN1 lần lượt là 27 % và 23 % [ 23 ], [ 24 ] .
LOH hay được tìm thấy trong những gen ức chế ung thư và những nhiễm sắc thể ( NST ) chứa những gen này : NST 17 p mã hóa gen TP53, NST 3 p mã hóa gen RAS – thuộc hệ gen 1A ( RASSF1A ), NST 9 p mã hóa gen p16-INK4a và p14-ARF, NST 18 q mã hóa những gen DCC, DPC4 / SMAD4 và SMAD2. Tỷ lệ đột biến TP53 giao động từ 4-44 % [ 23 ], tuy nhiên không có đột biến gen p16-INK4a hoặc gen smad4 / DPC4 nào được tìm thấy ở BN UTKNTĐTH [ 25 ] .
UTKNTĐTH thường biểu lộ thực trạng methyl hóa so với những gen RASSF1A, p14-ARF, retinoic acid receptor beta 2 ( RARβ ) O6-methyl-guanine methyltransferase ( MGMT ), cyclooxygenase 2 ( COX-2 ), thrombospondin 1 ( THBS1 ), estrogen receptor ( ER ), and hypermethylated in cancer 1 ( HIC-1 ) [ 24 ]. Metyl hóa p16-INK4 phát hiện ở 33 % những trường hợp UTKNTĐTH theo điều tra và nghiên cứu của Liu và tập sự [ 26 ]. Cũng theo điều tra và nghiên cứu này, thực trạng methyl hóa gen RASSF1A thường dự báo cho thực trạng di căn hạch hoặc di căn xa [ 26 ] .
TÀI LIỆU THAM KHẢO
Xem thêm: Hướng dẫn và ví dụ String trong Python
1. FT B., F C., RH H., et al. WHO Classification of Tumours of the Digestive System, .
2. Choe J.,
Kim K.W., Kim H.J., et al. (2019). What Is New in the 2017 World Health
Organization Classification and 8th American Joint Committee on Cancer Staging
System for Pancreatic Neuroendocrine Neoplasms?. Korean J Radiol, 20(1),
5–17.
3. Sorbye
H., Strosberg J., Baudin E., et al. (2014). Gastroenteropancreatic high-grade
neuroendocrine carcinoma. Cancer, 120(18), 2814–2823.
4. Basturk
O., Yang Z., Tang L.H., et al. (2015). The high-grade (WHO G3) pancreatic
neuroendocrine tumor category is morphologically and biologically heterogenous
and includes both well differentiated and poorly differentiated neoplasms. Am
J Surg Pathol, 39(5), 683–690.
5. Tang
L.H., Basturk O., Sue J.J., et al. (2016). A Practical Approach to the
Classification of WHO Grade 3 (G3) Well-differentiated Neuroendocrine Tumor
(WD-NET) and Poorly Differentiated Neuroendocrine Carcinoma (PD-NEC) of the
Pancreas. Am J Surg Pathol, 40(9), 1192–1202.
6. TNM
Classification of Malignant Tumours, 7th Edition | Wiley. Wiley.com,
,
accessed: 09/21/2020.
7. Rindi
G., Klöppel G., Couvelard A., et al. (2007). TNM staging of midgut and hindgut
(neuro) endocrine tumors: a consensus proposal including a grading system. Virchows
Arch Int J Pathol, 451(4), 757–762.
8. Rindi
G., Klöppel G., Alhman H., et al. (2006). TNM staging of foregut
(neuro)endocrine tumors: a consensus proposal including a grading system. Virchows
Arch Int J Pathol, 449(4), 395–401.
9. Amin
M.B., Greene F.L., Edge S.B., et al. (2017). The Eighth Edition AJCC Cancer
Staging Manual: Continuing to build a bridge from a population-based to a more
“personalized” approach to cancer staging. CA Cancer J Clin, 67(2),
93–99.
10. Lloyd
R.V. (2003). Practical markers used in the diagnosis of neuroendocrine tumors. Endocr
Pathol, 14(4), 293–301.
11. Rindi G., Villanacci V., and Ubiali A. (2000). Biological and molecular aspects of gastroenteropancreatic neuroendocrine tumors. Digestion, 62 Suppl 1, 19–26.
12. Koo J.,
Mertens R.B., Mirocha J.M., et al. (2012). Value of Islet 1 and PAX8 in
identifying metastatic neuroendocrine tumors of pancreatic origin. Mod
Pathol Off J U S Can Acad Pathol Inc, 25(6), 893–901.
13. Scoazec
J.-Y., Couvelard A., Monges G., et al. (2017). Professional Practices and
Diagnostic Issues in Neuroendocrine Tumour Pathology: Results of a Prospective
One-Year Survey among French Pathologists (the PRONET Study). Neuroendocrinology,
105(1), 67–76.
14. Konukiewitz
B., Enosawa T., and Klöppel G. (2011). Glucagon expression in cystic pancreatic
neuroendocrine neoplasms: an immunohistochemical analysis. Virchows Arch Int
J Pathol, 458(1), 47–53.
15. Garbrecht
N., Anlauf M., Schmitt A., et al. (2008). Somatostatin-producing neuroendocrine
tumors of the duodenum and pancreas: incidence, types, biological behavior,
association with inherited syndromes, and functional activity. Endocr Relat
Cancer, 15(1), 229–241.
16. Yang Z.,
Klimstra D.S., Hruban R.H., et al. (2017). Immunohistochemical Characterization
of the Origins of Metastatic Well-differentiated Neuroendocrine Tumors to the
Liver. Am J Surg Pathol, 41(7), 915–922.
17. Yang
M.X., Coates R.F., Ambaye A., et al. (2018). NKX2.2, PDX-1 and CDX-2 as
potential biomarkers to differentiate well-differentiated neuroendocrine
tumors. Biomark Res, 6(1), 15.
18. Brenner B., Tang L.H., Klimstra D.S., et al. (2004). Small-cell carcinomas of the gastrointestinal tract: a review. J Clin Oncol Off J Am Soc Clin Oncol, 22(13), 2730–2739.
19. Tasso D.M., Attam R., Aslan D.L., et al. (2012). Endoscopic ultrasound guided fine-needle aspiration diagnosis of duodenal high grade neuroendocrine carcinoma underlying a villous adenoma: report of a case. Diagn Cytopathol, 40(1), 62–68.
20. Yang Z., Tang L.H., and Klimstra D.S. (2011). Effect of tumor heterogeneity on the assessment of Ki67 labeling index in well-differentiated neuroendocrine tumors metastatic to the liver: implications for prognostic stratification. Am J Surg Pathol, 35(6), 853–860.
21. Couvelard A., Deschamps L., Ravaud P., et al. (2009). Heterogeneity of tumor prognostic markers: a reproducibility study applied to liver metastases of pancreatic endocrine tumors. Mod Pathol, 22(2), 273–281.
22. Oneda E., Liserre B., Bianchi D., et al. (2019). Diagnosis of Mixed Adenoneuroendocrine Carcinoma (MANEC) after Neoadjuvant Chemotherapy for Pancreatic and Gastric Adenocarcinoma: Two Case Reports and a Review of the Literature. Case Rep Oncol, 12(2), 434–442.
23. Rindi G. and Bordi C. (2005). Endocrine tumours of the gastrointestinal tract: aetiology, molecular pathogenesis and genetics. Best Pract Res Clin Gastroenterol, 19(4), 519–534.
24. Arnold C.N., Sosnowski A., Schmitt-Gräff A., et al. (2007). Analysis of molecular pathways in sporadic neuroendocrine tumors of the gastro-entero-pancreatic system. Int J Cancer, 120(10), 2157–2164.
25. Stancu M., Wu T.-T., Wallace C., et al. (2003). Genetic alterations in goblet cell carcinoids of the vermiform appendix and comparison with gastrointestinal carcinoid tumors. Mod Pathol Off J U S Can Acad Pathol Inc, 16(12), 1189–1198.
26. Liu L., Broaddus R.R., Yao J.C., et al. (2005). Epigenetic alterations in neuroendocrine tumors: methylation of RAS-association domain family 1, isoform A and p16 genes are associated with metastasis. Mod Pathol Off J U S Can Acad Pathol Inc, 18(12), 1632–1640.
Source: http://139.180.218.5
Category: Thuật ngữ đời thường