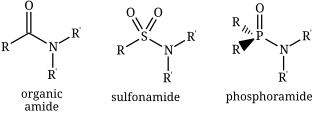
 Cấu trúc của ba loại amid : một amid hữu cơ, một sulfonamid và một phosphoramid .
Cấu trúc của ba loại amid : một amid hữu cơ, một sulfonamid và một phosphoramid .
Một amid ( hoặc hoặc ),[1][2][3] cũng được biết đến như một axit amid, là một hợp chất với các nhóm chức RnE(O)xNR′2 (R và R’ là các nhóm H hoặc nhóm hữu cơ). Phổ biến nhất là carboxamid (hữu cơ amit) (n = 1, E = C x = 1), nhưng nhiều loại amid khác quan trọng được biết đến, bao gồm cả phosphoramid (n = 2, E = P x = 1 và rất nhiều công thức liên quan) và sulfonamid (E = S, x = 2).[4] Thuật ngữ amid đề cập cả đến các nhóm của các hợp chất và các nhóm chức (RnE(O)xNR’2) trong những hợp chất trên.
Amid có thể còn đề cập đến axit liên hợp của ammoniac (các cation H2N−) hay của một amine hữu cơ (một cation R2N−).
Phần còn lại của bài viết này nói về amid carbonyl–nitơ.
Bạn đang đọc: Amid – Wikipedia tiếng Việt
Cấu trúc và link.
Amid đơn thuần nhất là những dẫn xuất của ammoniac trong đó một nguyên tử hydro đã được sửa chữa thay thế bằng một nhóm acyl. Cấu trúc này thường được miêu tả đại diện thay mặt như RC ( O ) NH2 và được miêu tả như một amide chính. Liên quan ngặt nghèo và nhiều hơn nữa là những amid thứ sinh hoàn toàn có thể được bắt nguồn từ những amin chính ( R ′ NH2 ) và có công thức RC ( O ) NHR ′. Các amit bậc ba thường có nguồn gốc từ những amin thứ cấp ( R ′ R ″ NH ) và có cấu trúc chung là RC ( O ) NR ′ R ″. Amid thường được coi là dẫn xuất của những axit cacboxylic trong đó nhóm hydroxyl bị sửa chữa thay thế bằng một amin hoặc amonia .
Cặp electron đơn độc của nitơ được ghép vào nhóm carbonyl, và tạo ra một link đôi một phần giữa N và carbonyl carbon. Do đó, ni tơ trong amit không phải là hình chóp. Người ta ước tính rằng acetamid được diễn đạt bởi cấu trúc cộng hưởng A cho 62 % và của B là 28 % ( không bằng 100 % chính bới có những hình cộng hưởng bổ trợ không được miêu tả trong hình trên ). [ 5 ]
Theo cách đặt tên danh mục thông thường, người ta thêm từ “amid” vào gốc của tên của axit mẹ. Ví dụ, amit bắt nguồn từ axit axetic is được gọi là acetamid (CH3CONH2). IUPAC đề nghị tên ethanamid, nhưng tên chính thức và các tên liên quan này hiếm khi gặp phải. Khi amit có nguồn gốc từ amin bậc nhất hoặc thứ cấp, các gốc thế trên nitơ được chỉ ra trước tiên trong tên. Do đó, amid hình thành từ dimethylamin và axit axetic là N,N-dimethylacetamide (CH3CONMe2, trong đó Me = CH3). Thông thường ngay cả tên này cũng được đơn giản hóa thành dimethylacetamid. Các amide vòng được gọi là lactam; chúng nhất thiết là amid bậc 2 hoặc bậc ba. Các nhóm chức năng bao gồm –P(O)NR2 và –SO2NR2 tương ứng là phosphonamid và sulfonamid.[6]
Xem thêm: Đầu số 0127 đổi thành gì? Chuyển đổi đầu số VinaPhone có ý nghĩa gì? – http://139.180.218.5
So sánh với amin, các amid là các base rất yếu.. Trong khi axit liên hợp của một amin có pKa khoảng 9.5, axit liên hợp của amid chỉ có pKa vào khoảng −0.5. Do đó, các amit không có đặc tính axid-base rõ ràng trong nước. Sự thiếu hụt tương đối của tính base này được giải thích bằng tính hút electron của nhóm carbonyl nơi mà cặp electron đơn lẻ trên nitơ bị trục xuất do cộng hưởng. Mặt khác, amid là các base mạnh hơn nhiều so với axit cacboxylic, este, aldehyd, và keton (các axit liên hợp của chúng có pKas từ −6 đến −10). Mô phỏng trên máy tính cho thấy acetamid được biểu diễn bởi cấu trúc cộng hưởng A cho 62% và bởi B cho 28%. Phần lớn cộng hưởng được ngăn ngừa trong quinuclidone bị giới hạn.
Do sự ngày càng tăng oxy điện của oxy, nên carbonyl ( C = O ) là một lưỡng cực mạnh hơn lưỡng cực N – C. Sự hiện hữu của lưỡng cực C = O và, đến một mức độ thấp hơn, lưỡng cực N – C được cho phép những amid hoạt động giải trí như những chất gật đầu link hydro. Trong những amit sơ cấp và bậc 2, sự hiện hữu của lưỡng cực N – H được cho phép những amit có công dụng như những nhà sản xuất link hydro. Do đó những amid hoàn toàn có thể tham gia link hydro với nước và những dung môi tiên tiến và phát triển khác ; nguyên tử oxy hoàn toàn có thể đồng ý những link hydro từ nước và những nguyên tử hydro N-H hoàn toàn có thể hiến Tặng những link hydro. Do những tương tác như vậy, độ tan trong nước của amid lớn hơn so với những hydrocarbon tương ứng .
Proton của amit nguyên sinh hoặc thứ cấp không tách rời dễ dàng trong điều kiện bình thường; chỉ số pKa của nó thường cao hơn 15. Ngược lại, trong điều kiện cực kỳ axit, oxy carbonyl có thể nhận proton với pKa gần bằng −1.
Độ hòa tan của các amid và este là khá tương đồng. Thường amid ít tan hơn khi so sánh với amin và axit cacboxylic vì các hợp chất này có thể vừa tặng vừa chấp nhận các liên kết hydro. Amid bậc ba, với ngoại lệ quan trọng của N,N-dimethylformamide có độ hòa tan thấp trong nước.
- Amide có thể tham gia phản ứng thuỷ phân(polyamide/ protein)
*Protein -> Axit amin
Phản ứng thuỷ phân amide đôi lúc ko được mong ước vì nó hoàn toàn có thể phá huỷ vật tư .
- Amide có thể bị khử thành amine
R
−
CO
−
N
(
R
1
)
R
2
+
2
H
2
⟶
R
−
CH
2
−
N
(
R
1
)
R
2
+
H
2
O
{\displaystyle {\ce {R-CO-N(R1)R2 + 2H2 -> R-CH2-N(R1)R2 + H2O}}}
Source: http://139.180.218.5
Category: Thuật ngữ đời thường
