Nội dung chính
Axit sunfuric là gì ?
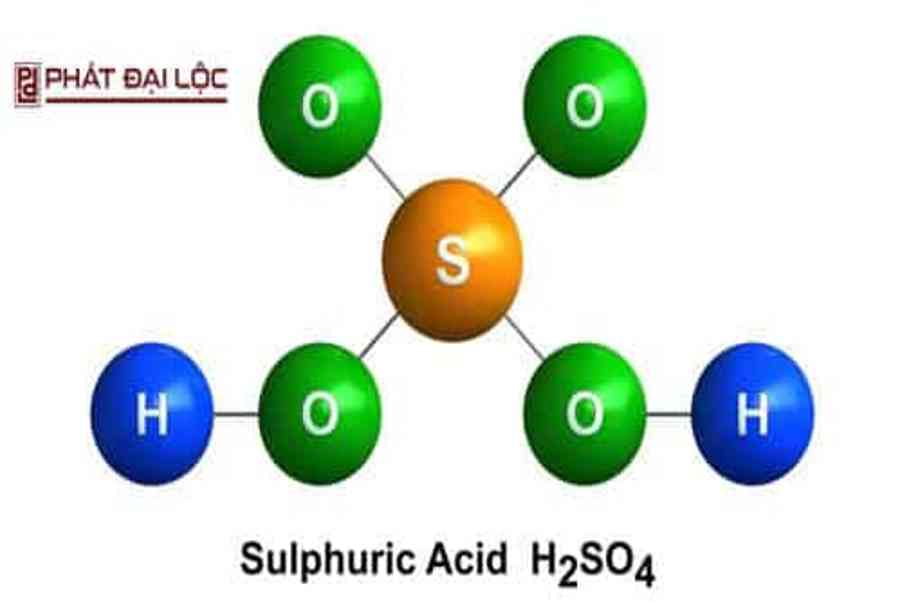
Axit sunfuric là một axit vô cơ gồm có lưu huỳnh, oxy và hydro. H2SO4 là một hóa chất không mùi vị, không sắc tố và có đặc tính nhớt, chúng hòa tan được trong nước ở phong phú những tỉ lệ và có phản ứng tỏa nhiệt mạnh .
Nó là một chất lỏng nhớt nhờn không bay hơi, gần như là gấp đôi nước ( H2SO4 98 % D = 1,84 g / cm3 ) Đặc biệt, do giữa axit sunfuric và nước có áp suất lớn nên hiếm khi tìm thấy H2SO4 tinh khiết trên toàn cầu .
Bên cạnh đó, H2SO4 còn là thành phần trong mưa axit và cấu trúc gồm có lưu huỳnh đioxit bị oxi hóa hay axit sunfuric bị oxi hóa trong nước. Chúng là một hóa chất được sử dụng làm nguyên vật liệu cũng như chất xúc tác trong nhiều ngành công nghiệp, sản xuất ..
Các nước trên quốc tế hàng năm sản xuất khoảng chừng hơn 150 triệu tấn H2SO4. và sử dụng chúng trong sản xuất thuốc trừ sâu, phân bón, chất dẻo và sơn hay những loại chất tẩy rửa tổng hợp .
Công thức hóa học của axit sunfuric : H2SO4
Tính chất vật lý của H2SO4
Axit sunfuric là hóa chất sống sót ở dạng lỏng, nhớt và có độ nặng hơn so với nước, tan trong nước và ít bay hơi .
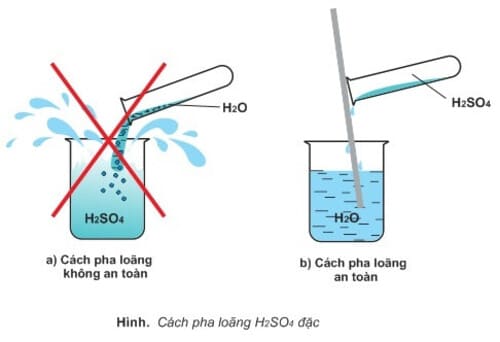
Axit sunfuric đặc sẽ hút nước mạnh và tỏa nhiệt nhiều nên khi điều chế làm loãng không được đổ nước vào axit sunfuric mà phải rót từ từ axit sunfuric vào, nếu không tuân thủ hoàn toàn có thể gây bỏng da
H2SO4 hoàn toàn có thể làm than hoạt hóa hợp chất hữu cơ .
Tính chất hóa học của H2SO4
Đối với Axit sunfuric tồn tại ở dạng loãng
Axit sunfuric làm chuyển màu quỳ tím hóa đỏ .
Tạo thành muối sunfat khi tính năng với sắt kẽm kim loại đứng trước H ( trừ Pb )
Fe + H2SO4 → FeSO4 + H2
Tạo thành muối mới khi tính năng với oxit bazơ ( trong đó sắt kẽm kim loại giữ nguyên hóa trị ) và nước .
FeO + H2SO4 → FeSO4 + H2O
Tạo thành muối mới axit sunfuric công dụng với muối ( trong đó sắt kẽm kim loại vẫn giữ nguyên hóa trị ) và axit mới .
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2 O + 2CO2
Tạo thành muối mới và nước khi axit sunfuric tính năng với bazơ .
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2N aOH → Na2SO4 + 2H2 O
Đối với Axit sunfuric tồn tại ở dạng đặc
Axit sunfuric đặc có oxi hóa mạnh và tính axit mạnh, có những đặc thù sau
Tác dụng với sắt kẽm kim loại : Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc .
Cu + 2H2 SO4 → CuSO4 + SO2 + 2H2 O
Tác dụng với phi kim tạo thành oxit phi kim và nước, giải phóng khí SO2
C + 2H2 SO4 → CO2 + 2H2 O + 2SO2 ( nhiệt độ )
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
Tác dụng với các chất khử khác:
2F eO + 4H2 SO4 → Fe2 ( SO4 ) 3 + SO2 + 4H2 O
H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau :
C12H22O11 + H2SO4 → 12C + H2SO4. 11H2 O
Cách điều chế axit sunfuric
Axit sunfuric ( H2SO4 ) được điều chế bằng việc đốt cháy quặng pirit sắt ; Oxi hóa SO2 trải qua oxi ở nhiệt độ tiêu chuẩn 400 – 500 độ C ; Hoặc pha loãng chất oleum để tạo ra H2SO4 khi có lượng nước thích hợp …
FeS2 hoặc S → SO2 → SO3 → H2SO4
Đốt cháy quặng pirit sắt:
4F eS2 + 11O2 → 8SO2 + 2F e2O3
Oxi hóa SO2 thông qua oxi trong điều kiện nhiệt độ 400 – 5000C, và cần chất xúc tác V2O
2SO2 + O2 → 8SO3
Axit sunfuric đặc hấp thụ SO3 tạo thành oleum có công thức tổng quát là H2SO4.nSO3:
nSO3 + H2SO4 → H2SO4. nSO3
Pha loãng oleum thành axit sunfuric bằng lượng nước thích hợp:
H2SO4. nSO3 + ( n + 1 ) H2O → ( n + 1 ) H2SO4
Các dạng của axit sunfuric H2SO4
Mặc dù hoàn toàn có thể tạo ra 100 % axit sunfuric, nhưng ở điểm sôi nó mất SO3 để tạo thành axit 98,3 %. Các nồng độ khác nhau của axit sunfuric được sử dụng cho nhiều mục tiêu khác nhau, ví dụ điển hình như :
Axit sunfuric loãng dùng trong phòng thí nghiệm thường chỉ 10 %. so với pin khoảng chừng 33,5 %. Hàm lượng 62,18 % là axit được sử dụng để làm phân bón. 77,67 % được sử dụng trong những tháp sản xuất. hoặc găng tay axit. 98 % là axit đặc .
Tương ứng với mỗi mục tiêu sử dụng Axit sunfuric sẽ có những dạng khác nhau ví dụ điển hình như : Axit sunfuric loãng, được sử dụng trong phòng thí nghiệm, nói chung chỉ có 10 %. Nó được sử dụng cho pin khoảng chừng 33,5 %. Loại 62,18 % là axit được sử dụng để sản xuất phân bón, 77,67 % được sử dụng trong tháp sản xuất, hoặc axit Glover 98 % là axit đậm đặc .
Ứng dụng của axit sunfuric
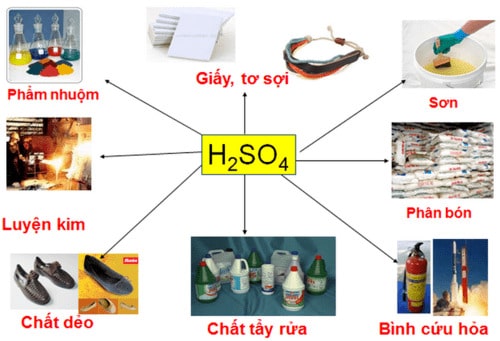
Trong sản xuất công nghiệp
Axit sunfuric được ứng dụng trong những quy trình tiến độ để tạo ra sắt kẽm kim loại như kẽm, đồng hoặc giải pháp làm sạch và tẩy gỉ mặt phẳng thép .
Ngoài ra, H2SO4 còn được dùng trong sản xuất nhôm sunfat. Sản xuất sunphat, làm sạch sắt kẽm kim loại trước khi mạ điện, sản xuất thuốc nổ, chất dẻo, thuốc nhuộm, sản xuất thuốc. Hỗn hợp axit và nước được sử dụng làm chất điện phân trong những loại pin khác nhau, axit chì … Hỗn hợp axit và nước được sử dụng làm chất điện phân trong những loại pin khác nhau, axit chì …
Trong sản xuất phân bón
Axit photphoric được tạo ra từ H2SO4 được dùng để tạo ra những loại phân photphat, amoni photphat canxi dihydrogen photphat và cũng dùng để tạo Amoni sunfat .
Trong giải quyết và xử lý nước thải
Axit sunfuric tạo nhôm hidroxit dùng trong những nhà máy sản xuất giải quyết và xử lý nước để vô hiệu tạp chất, trung hòa pH và lọc bỏ những ion Ca2 +, Mg2 + có trong thiên nhiên và môi trường nước thải
Trong phòng thí nghiệm
- Dùng trong điều chế các axit yếu chẳng hạn như: HNO3. HCl ở trong thí nghiệm.
- Axit sunfuric còn tạo ra nhiều ứng dụng trong đời sống
Lưu ý khi sử dụng H2SO4
Khi pha loãng H2SO4 cần cho từ từ axit vào nước không nên làm theo hướng ngược lại vì sẽ dễ gây nhiều hậu quả tác động ảnh hưởng sức khỏe thể chất
Do đặc thù nguy khốn của axit sunfuric nên khi sử dụng ta cần quan tâm trang bị bảo lãnh tạp dề PVC, tấm che mặt, găng tay …
Khi dữ gìn và bảo vệ cần tránh những loại chất khử và bazơ để tránh những công dụng khác. Vì nó là một chất ăn mòn sắt kẽm kim loại mạnh .
Mua hóa chất sunfuric chất lượng tại đâu ?
Để tìm cho mình địa chỉ bán hóa chất sunfuric chất lượng, quý vị có thể liên hệ trực tiếp qua hotline : 0904 3979 77 hoặc website công ty hóa chất Phát Đại Lộc để được tư vấn miễn phí.
Bài viết trên đây đã tổng hợp những thông tin về axit sunfuric ( H2SO4 ). Hy vọng bạn sẽ hiểu rõ hơn về những đặc thù cũng như những ứng dụng cũng như tìm cho mình địa chỉ mua hóa chất uy tín nhé !
Xem thêm : FeCl2 là gì ? Có những ứng dụng gì trong đời sống
Source: http://139.180.218.5
Category: Thuật ngữ đời thường