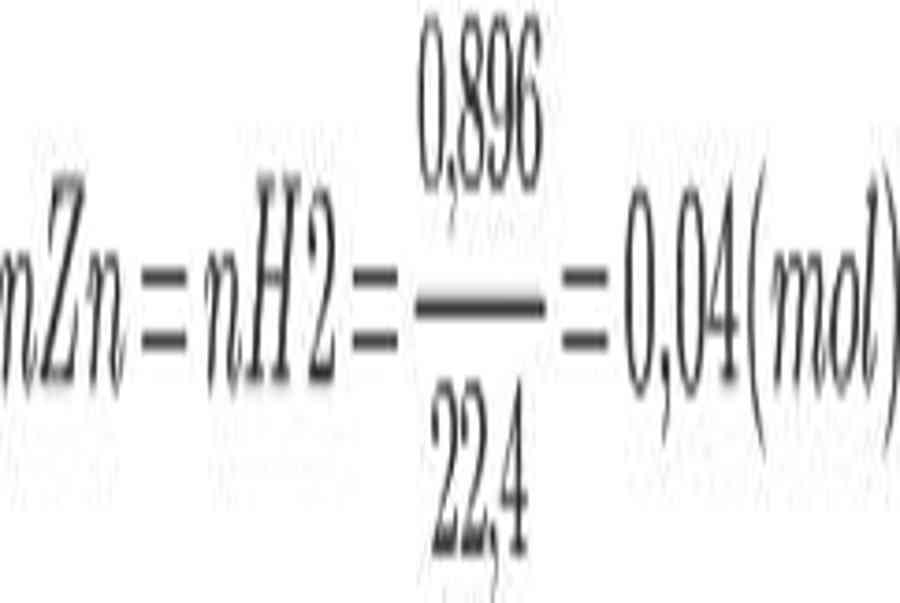Nội dung chính
Ăn mòn điện hóa, ăn mòn hóa học là gì ?
Chủ đề Hóa Học 12 hôm nay chúng ta sẽ tìm hiểu về hiện tượng ăn mòn điện hóa và ăn mòn hóa học, để lí giải tại sao một thanh sắt nói riêng và kim loại nói chung khi để ngoài trời hay ngâm trong nước thì lại bị rỉ sét? Đây được xem là một hiện tượng ăn mòn kim loại. Còn về chi tiết hiện tượng này, chúng ta sẽ tìm hiểu ngay sau đây.

Nội dung chính
Bạn đang xem : Ăn mòn điện hóa, ăn mòn hóa học là gì ?
-
Ăn mòn kim loại
- Ăn mòn hóa học
-
Ăn mòn điện hóa học
- Cơ chế của ăn mòn điện hóa
- Điều kiện để xảy ra sự ăn mòn điện hóa học
- Các biện pháp chống ăn mòn kim loại
- Bài tập
Ăn mòn kim loại
– Sự ăn mòn sắt kẽm kim loại là sự tàn phá sắt kẽm kim loại hoặc hợp kiim do tính năng của những chất trong môi trường tự nhiên xung quanh. Đó là một quy trình hóa học, hoặc quy trình điện hóa trong đó sắt kẽm kim loại bị oxi hóa thành ion dương .
X — -> X ( n + ) + ne
– Ăn mòn sắt kẽm kim loại gồm hai dạng là : ăn mòn hóa học và ăn mòn điện hóa học .
Ăn mòn hóa học
– Ăn mòn hóa học là quy trình oxi hóa khử trong đó những electron của sắt kẽm kim loại được chuyển trực tiếp đến những chất trong thiên nhiên và môi trường .
– Ăn mòn hóa học thường xảy ra ở những cụ thể bằng sắt kẽm kim loại của máy móc hoặc những thiết bị liên tục phải tiếp xúc với hóa chất, khí oxi, hơi nước ở nhiệt độ cao. Nhiệt độ càng cao, sắt kẽm kim loại ăn mòn càng nhanh .
– Nhận biết ăn mòn hóa học, ta thấy ăn mòn sắt kẽm kim loại mà không thấy Open cặp sắt kẽm kim loại hay cặp KL-C thì đó là ăn mòn sắt kẽm kim loại .
Ví dụ: Thanh sắt nói riêng khi ngâm trong nước lại bị gỉ sét.
Đến đây tất cả chúng ta hoàn toàn có thể lý giải như sau : Khi sắt tiếp xúc với oxy và nhiệt độ trong một khoảng chừng thời hạn dài, tạo thành một hợp chất mới gọi là oxít sắt hay còn gọi là rỉ sắt. Chất xúc tác chính cho quy trình rỉ là nước. Cấu trúc sắt có vẻ như chắc như đinh, nhưng những phân tử nước hoàn toàn có thể xâm nhập vào những lỗ nhỏ và vết nứt trong bất kể sắt kẽm kim loại nào kể cả sắt, sự tích hợp của nguyên tử hidro có trong nước với những nguyên tố khác để hình thành axít, ăn mòn sắt, làm cho sắt bị phơi ra nhiều hơn. Nếu trong môi trường tự nhiên nước biển, sự ăn mòn hoàn toàn có thể xảy ra nhanh hơn. Trong khi đó những nguyên tử oxy phối hợp với những nguyên tử sắt để hình thành oxít sắt hay rỉ sắt, chúng làm yếu sắt và làm cho cấu trúc của sắt trở nên giòn và xốp .

Ăn mòn điện hóa học
– Ăn mòn điện hóa học là quy trình oxi hóa – khử, trong đó sắt kẽm kim loại bị ăn mòn do tính năng của dung dich chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương .
– Ăn mòn điện hóa thường xảy ra khi cặp sắt kẽm kim loại ( hoặc kim loại tổng hợp ) để ngoài không khí ẩm, hoặc nhúng trong dung dịch axit, dung dịch muối, trong nước không nguyên chất …
Ví dụ : Phần vỏ tàu biển chìm trong nước, ống dẫn đặt trong lòng đất, sắt kẽm kim loại tiếp xúc với không khí ẩm … Do vậy, ăn mòn điện hóa là loại ăn mòn sắt kẽm kim loại thông dụng và nghiêm trọng nhất
Cơ chế của ăn mòn điện hóa
– Gang hoặc thép là những kim loại tổng hợp Fe-C, trong đó cực âm là những tinh thể Fe, cực dương là những tinh thể C. Các điện cực này tiếp xúc trực tiếp với nhau và với một dung dịch điện li phủ ngoài. Như vậy, vật bị ăn mòn theo kiểu điện hóa :
+ Ở cực âm : Các nguyên tử Fe bị oxi hóa thành. Các ion này tan vào dung dịch điện li trong đó đã có một lượng không khí oxi, tại đây chúng bị oxi hóa tiếp thành .
+ Ở cực dương : Các ion hiđro của dung dịch điện li chuyển dời đến cực dương, tại đây chúng bị khử thành hiđro tự do, sau đó thoát ra khỏi dung dịch điện li .
Các tinh thể Fe lần lượt bị oxi hóa từ ngoài vào trong. Sau một thời hạn, vật bằng gang ( thép ) sẽ bị ăn mòn hết .
Điều kiện để xảy ra sự ăn mòn điện hóa học
– Các điện cực phải khác nhau về thực chất, hoàn toàn có thể là cặp 2 sắt kẽm kim loại khác nhau hoặc cặp sắt kẽm kim loại với phi kim, …
– Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn .
– Các điện cực cùng tiếp xúc với một dung dịch chất điện li
Thiếu một trong ba điều kiện kèm theo trên sẽ không xảy ra sự ăn mòn điện hóa học
Trong tự nhiên, sự ăn mòn sắt kẽm kim loại xảy ra phức tạp, hoàn toàn có thể xảy ra đồng thời cả quy trình ăn mòn điện hóa học và ăn mòn hóa học .
Các biện pháp chống ăn mòn kim loại
Phương pháp bảo vệ bề mặt
– Dùng những chất bền vững và kiên cố phủ lên mặt phẳng sắt kẽm kim loại như lớp sơn, dầu mỡ, chất dẻo …
– Lau chùi, để nơi khô ráo thoáng
– Sắt tây là sắt được tráng thiếc, tôn là sắt được tráng kẽm. Các vật phẩm bằng sắt thường được mạ Niken hay Crom
Phương pháp điện hóa
– Dùng một sắt kẽm kim loại là “ vật hi sinh ” để bảo vệ vật tư sắt kẽm kim loại .
VD: Để bảo vệ vỏ tàu biển bằng thép, người ta gắn các lá Zn vào phía ngoài vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện li). Kẽm bị ăn mòn, vỏ tàu được bảo vệ.
Bài tập
Bài 1: Vì sao khi nối một sợi dây điện bằng đồng với một sợi dây điện bằng nhôm thì chỗ nối mau trở nên kém tiếp xúc?
Trả lời :
Khi đồng và nhôm tiếp xúc trực tiếp nhau 1 thời hạn thì tại điểm tiếp xúc ấy xảy ra hiện tượng kỳ lạ “ ăn mòn điện hoá ”. Hiện tượng này làm phát sinh một chất có điện trở lớn, làm giảm dòng điện đi qua dây .
Bài 2: Một hợp kim có cấu tạo tinh thể hỗn hợp Cu – Zn để trong không khí ẩm. Hãy cho biết hợp kim bị ăn mòn hoá học hay điện hoá học.
Trả lời :
Hợp kim bị ăn mòn điện hoá học .
Zn là điện cực âm, bị ăn mòn. Cu là điện cực dương không bị ăn mòn .
Bài 3: Có những cặp kim loại sau đây tiếp xúc với nhau và cùng tiếp xúc với dung dịch điện li. Cho biết kim loại nào trong mỗi cặp sẽ bị ăn mòn điện hoá học.
a ) Al – Fe
b ) Cu – Fe
c ) Fe – Sn
Trả lời :
a ) Al ( điện cực âm ) bị ăn mòn, Fe ( điện cực dương ) không bị ăn mòn
b ) Fe ( điện cực âm ) bị ăn mòn, Cu ( điện cực dương ) không bị ăn mòn .
c ) Fe ( điện cực âm ) bị ăn mòn, Sn ( điện cực dương ) không bị ăn mòn .
Ở những vết sây sát của vật làm bằng sắt tráng kẽm sẽ xảy ra hiện tượng kỳ lạ ăn mòn điện hoá học .
Bài 4: Ngâm 9 g hợp kim Cu – Zn trong dung dịch axit HCl dư thu được 896 ml khí H2 (đktc). Hãy xác định thành phần phần trăm khối lượng của hợp kim.
Trả lời :
Zn + 2H + → Zn2 + + H2
![]()
=> mZn = 0,04. 65 = 2,6 ( g )
![]()
Sau khi học xong bài này, chúng ta đã có thể hiểu rõ hơn về những sự việc xảy ra hằng ngày xung quanh chúng ta, cùng như có thể giải thích được chúng. Ngoài ra, còn một số dạng bài tập hay được hỏi trong chủ đề sự ăn mòn điện hóa này. Các em nên sưu tầm và luyện tập thêm để có kết quả thật tốt nhé. Chúc các em học tốt!
Xem thêm: Đầu số 0127 đổi thành gì? Chuyển đổi đầu số VinaPhone có ý nghĩa gì? – http://139.180.218.5
Đăng bởi : trung học phổ thông Sóc Trăng
Chuyên mục : Giáo dục đào tạo
Source: http://139.180.218.5
Category: Thuật ngữ đời thường