Chì là một nguyên tố hóa học trong bảng tuần hoàn hóa học viết tắt là Pb (Latin: Plumbum) và có số nguyên tử là 82. Chì có hóa trị phổ biến là II, có khi là IV. Chì là một kim loại mềm, nặng, độc hại và có thể tạo hình. Chì có màu trắng xanh khi mới cắt nhưng bắt đầu xỉn màu thành xám khi tiếp xúc với không khí. Chì dùng trong xây dựng, pin sạc, đạn, và là một phần của nhiều hợp kim. Chì có số nguyên tố cao nhất trong các nguyên tố bền.
Khi tiếp xúc ở một mức độ nhất định, chì là chất độc so với động vật hoang dã cũng như con người. Nó gây tổn thương cho hệ thần kinh và gây ra rối loạn não. Tiếp xúc ở mức cao cũng gây ra rối loạn máu ở động vật hoang dã. Giống với thủy ngân, chì là chất độc thần kinh tích tụ trong mô mềm và trong xương. Nhiễm độc chì đã được ghi nhận từ thời La Mã cổ đại, Hy Lạp cổ đại, và Trung Quốc cổ đại .
Chì từng được sử dụng phổ biến hàng ngàn năm trước do sự phân bố rộng rãi của nó, dễ chiết tách và dễ gia công. Nó dễ dát mỏng và dễ uốn cũng như dễ nung chảy. Các hạt chì kim loại có tuổi 6400 TCN đã được tìm thấy ở Çatalhöyük, Thổ Nhĩ Kỳ ngày nay.[2] Vào đầu thời kỳ đồ đồng, chì được sử dụng cùng với antimon và asen.
Bạn đang đọc: Chì – Wikipedia tiếng Việt
Nhà sản xuất chì lớn nhất trước thời kỳ công nghiệp là nền kinh tế tài chính La Mã, với sản lượng hàng năm 80.000 tấn, đặc biệt quan trọng chúng là phụ phẩm của quy trình nung chảy bạc. [ 1 ] [ 3 ] [ 4 ] Hoạt động khai thác mỏ của La Mã diễn ra ở Trung Âu, Anh thuộc La Mã, Balkans, Hy Lạp, Tiểu Á ; riêng ở Hispania chiếm 40 % sản lượng toàn thế giới. [ 1 ]Các ống chì La Mã thường khảm lên phù hiệu của những nhà vua La Mã. Đường ống dẫn nước bằng chì ở Tây Latin hoàn toàn có thể đã được duy trì vượt qua thời kỳ Theodoric Đại đế tới tận thời Trung Cổ. [ 5 ] Một số thỏi chì La Mã tượng trưng cho lịch sử dân tộc khai thác chì Derbyshire và trong lịch sử dân tộc công nghiệp của những TT kinh tế tài chính ở Anh khác. Người La Mã cũng sử dụng chì nóng chảy để giữ những chân trụ sắt kết nối với những khối đá vôi lớn ở những nhà thời thánh nhất định. Trong giả kim thuật, chì từng được cho là sắt kẽm kim loại cổ nhất và tương quan đến Sao Thổ. Các nhà giả kim thuật sử dụng hình tượng của Sao Thổ ( ♄ ) để ám chỉ chì .
Ký hiệu của chì Pb là chữ viết tắt từ tên tiếng Latin plumbum nghĩa là kim loại mềm; có nguồn gốc từ plumbum nigrum (“plumbum màu đen”), trong khi plumbum candidum (nghĩa là “plumbum sáng màu”) là thiếc.
Nội dung chính
Tính chất vật lý.
Chì có màu trắng bạc và sáng, bề mặt cắt còn tươi của nó xỉ nhanh trong không khí tạo ra màu tối. Nó là sắt kẽm kim loại màu trắng xanh, rất mềm, dễ uốn và nặng, và có tính dẫn điện kém so với những sắt kẽm kim loại khác. Chì có tính chống ăn mòn cao, và do thuộc tính này, nó được sử dụng để chứa những chất ăn mòn ( như acid sulfuric ). Do tính dễ dát mỏng và chống ăn mòn, nó được sử dụng trong những khu công trình thiết kế xây dựng như trong những tấm phủ bên ngoài những khới lợp. Chì sắt kẽm kim loại hoàn toàn có thể làm cứng bằng cách thêm vào một lượng nhỏ antimony, hoặc một lượng nhỏ những sắt kẽm kim loại khác như calci .Chì dạng bột cháy cho ngọn lửa màu trắng xanh. Giống như nhiều sắt kẽm kim loại, bộ chì rất mịn có năng lực tự cháy trong không khí. [ 6 ] Khói độc phát ra khi chì cháy .
Tính chất hóa học.
Các dạng oxy hóa khác nhau của chì thuận tiện bị khử thành sắt kẽm kim loại. Ví dụ như khi nung PbO với những chất khử hữu cơ như glucose. Một hỗn hợp oxide và sulfide chì nung cùng nhau cũng tạo thành sắt kẽm kim loại. [ 7 ]
- 2 PbO + PbS → 3 Pb + SO2
Chì sắt kẽm kim loại chỉ bị oxy hóa ở vẻ bên ngoài trong không khí tạo thành một lớp chì oxide mỏng dính, chính lớp oxide này lại là lớp bảo vệ chì không bị oxy hóa tiếp. Chì sắt kẽm kim loại không phản ứng với những acid sulfuric hoặc clohydric. Nó hòa tan trong acid nitric giải phóng khí nitơ oxide và tạo thành dung dịch chứa Pb ( NO3 ) 2 .
- 3 Pb + 8 H+ + 8
NO
−
3→ 3 Pb2+ + 6
NO
−
3+ 2 NO + 4 H2O
Khi nung với những nitrat của sắt kẽm kim loại kiềm, chì bị oxy hóa thành PbO, và sắt kẽm kim loại kiềm nitrat. PbO đặc trưng cho mức oxy hóa + 2 của chì. Nó hòa tan trong acid nitric và acetic tạo thành những dung dịch có năng lực kết tủa những muối của chì sulfat, Chromiat, cacbonat ( PbCO3 ), và Pb3 ( OH ) 2 ( CO3 ) 2. Chì sulfide cũng hoàn toàn có thể được kết tủa từ những dung dịch acetat. Các muối này đều rất kém hòa tan trong nước. Trong số những muối halide, iodide là ít hòa tan hơn bromide, và bromide ít hòa tan hơn chloride. [ 8 ]Chì ( II ) oxide cũng hòa tan trong những dung dịch hydroxide sắt kẽm kim loại kiềm để tạo thành muối plumbit tương ứng. [ 7 ]
- PbO + 2 OH− + H2O →
Pb(OH)
2−
4
Clo hóa những dung dịch muối trên sẽ tạo ra chì có trạng thái oxy hóa + 4 .
-
Pb(OH)
2−
4+ Cl2 → PbO2 + 2 Cl− + 2 H2O
Chì dioxide là một chất oxy hóa mạnh. Muối clo ở trạng thái oxy hóa này khó được tạo ra và dễ bị phân hủy thành chì ( II ) chloride và khí clo. Muối iodide và bromide của chì ( IV ) không sống sót. [ 8 ] Chì dioxide hòa tan trong những dung dịch hydroxide sắt kẽm kim loại kiềm để tạo ra những muối plumbat tương ứng. [ 7 ]
- PbO2 + 2 OH− + 2 H2O →
Pb(OH)
2−
6
Chì cũng có trạng thái oxy hóa trộn lẫn giữa +2 và +4, đó là chì đỏ (Pb
3O
4).
Chì thuận tiện tạo thành kim loại tổng hợp đồng mol với sắt kẽm kim loại natri, kim loại tổng hợp này phản ứng với những alkyl halide tạo thành những hợp chất hữu cơ sắt kẽm kim loại của chì như tetraethyl chì. [ 9 ]
Các phức chất với clo.
Các hợp chất chì ( II ) tạo một loạt những phức chất với ion chloride, với sự hình thành của chúng làm đổi khác sự ăn mòn hóa học của chì. Quá trình này sẽ hạn chế năng lực hòa tan của chì trong môi trường tự nhiên mặn .
| Pb2+ + Cl− → PbCl+ | K1 = 12,59 |
| PbCl+ + Cl− → PbCl2 | K2 = 14,45 |
| PbCl2 + Cl− → PbCl3− | K3 = 3,98 ×10−1 |
| PbCl3− + Cl− → PbCl42− | K4 = 8,92 × 10−2 |
Các biểu đồ pha hòa tan của chì.
Chì ( II ) sulfat có năng lực hòa tan kém, như biểu lộ trên biểu đồ pha khi thêm SO42 − vào dung dịch 0,1 M Pb2 +. pH của dung dịch là 4,5, và khi lớn hơn giá trị đó, nồng độ Pb2 + hoàn toàn có thể không khi nào đạt đến 0,1 M do sự tạo thành Pb ( OH ) 2. Quan sát sự hòa tan của Pb2 + giảm 10.000 lần khi SO42 − đạt đến 0,1 M .

|
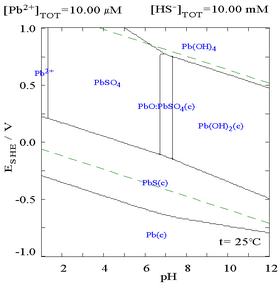
|
| Đồ thị biểu diễn nồng độ dung dịch của Pb2+ hòa tan biến thiên theo SO42− | Biểu đồ biểu diễn chì trong dung dịch sulfat |
Khi thêm chloride vào hoàn toàn có thể làm giảm năng lực hòa tan của chì, mặc dầu trong dung dịch giàu chloride ( như aqua regia ) thì chì hoàn toàn có thể hòa tan trở lại ở dạng anion phức-clo .

|
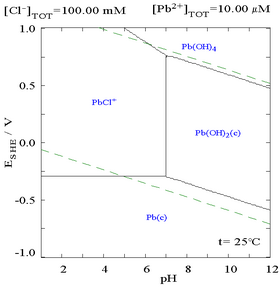
|
| Đồ thị biểu diễn khả năng hòa tan của chì trong dung dịch cloura. Các giá trị nồng độ chì được biểu diễn theo tổng chloride. |
Biểu đồ biểu diễn chì trong dung dịch chloride (0,1 M) |
Một đồng vị phân rã từ phóng xạ phổ cập là 202P b, có chu kỳ luân hồi bán rã là 53.000 năm. [ 11 ]Tất cả những đồng vị của chì, trừ chì 204, hoàn toàn có thể được tìm thấy ở dạng những loại sản phẩm cuối của quy trình phân rã phóng xạ của những nguyên tố nặng hơn như urani và thori .
 Các mỏ clastic và cacbonat chứa chì và kẽm. Nguồn : USGSChì sắt kẽm kim loại có sống sót trong tự nhiên nhưng ít gặp. Chì thường được tìm thấy ở dạng quặng cùng với kẽm, bạc, và ( phổ cập nhất ) đồng, và được tịch thu cùng với những sắt kẽm kim loại này. Khoáng chì hầu hết là galena ( PbS ), trong đó chì chiếm 86,6 % khối lượng. Các dạng khoáng chứa chì khác như cerussite ( PbCO3 ) và anglesite ( PbSO4 ) .
Các mỏ clastic và cacbonat chứa chì và kẽm. Nguồn : USGSChì sắt kẽm kim loại có sống sót trong tự nhiên nhưng ít gặp. Chì thường được tìm thấy ở dạng quặng cùng với kẽm, bạc, và ( phổ cập nhất ) đồng, và được tịch thu cùng với những sắt kẽm kim loại này. Khoáng chì hầu hết là galena ( PbS ), trong đó chì chiếm 86,6 % khối lượng. Các dạng khoáng chứa chì khác như cerussite ( PbCO3 ) và anglesite ( PbSO4 ) .
Chế biến quặng.
Hầu hết quặng chì chứa ít hơn 10 % chì, và những quặng chứa tối thiểu 3 % chì hoàn toàn có thể khai thác có hiệu suất cao kinh tế tài chính. Quặng được nghiền và cô đặc bằng tuyển nổi bọt thường thì đạt đến 70 % hoặc hơn. Các quặng sulfide được thiêu kết hầu hết tạo ra chì oxide và một hỗn hợp sulfat và silicat của chì và những sắt kẽm kim loại khác có trong quặng. [ 12 ]Chì oxide từ quy trình thiêu kết được khử trong lò cao bằng than cốc. [ 13 ] Quá trình này chuyển hầu hết chì thành dạng sắt kẽm kim loại. Ba lớp khác tách biệt nhau trong quy trình này và nổi lên đỉnh của chì sắt kẽm kim loại. Chúng là xỉ ( silicat chứa 1,5 % chì ), matte ( sulfide chứa 15 % chì ), và speiss ( asenua của sắt và đồng ). Các chất thải này chứa chì, kẽm, cadmi, và bismuth ở những mức hàm lượng hoàn toàn có thể được tịch thu một cách có kinh tế tài chính. [ 12 ]Chì sắt kẽm kim loại tạo ra từ những quy trình thiêu kết và lò cao vẫn chứa một hàm lượng đáng kể những tạp chất asen, antimon, bismuth, kẽm, đồng, bạc và vàng. Dung dịch nóng chảy được giải quyết và xử lý trong lò lửa quặt với không khí, hơi nước và lưu huỳnh để oxy hóa những tạp chất, trừ bạc, vàng và bismuth. Các tạp chất đã bị oxy hóa sẽ bị vô hiệu khi chúng nổi lên đỉnh. [ 12 ] [ 14 ]Hầu hết những quặng chì chứa một lượng đáng kể bạc, và sắt kẽm kim loại nóng chảy cũng chứa bạc ở dạng tạp chất. Bạc sắt kẽm kim loại cũng như vàng bị loại ra và được tịch thu bằng chiêu thức Parkes. [ 7 ] [ 12 ] [ 14 ]Chì sau khi được tách bạc ra sẽ liên tục vô hiệu bismuth bằng chiêu thức Betterton-Kroll bằng cách giải quyết và xử lý hỗn hợp chì với calci và magnesi sắt kẽm kim loại để vô hiệu bismuth. [ 12 ] [ 14 ]Chì rất tinh khiết hoàn toàn có thể được tịch thu bằng quy trình điện phân chì nóng chảy theo giải pháp Betts. Phương pháp điện phân này sử dụng anốt là chì không tinh khiết và catốt là chì tinh khiết trong một bể điện phân với chất điện li là chì fluorosilicat ( PbSiF6 ) và acid hexafluorosilicic ( H2SiF6 ). [ 12 ] [ 14 ]
Sản xuất và tái chế.
 Một mẫu chìSản xuất và tiêu thụ chì đang tăng trên toàn quốc tế. Tổng sản lượng hàng năm vào khoảng chừng 8 triệu tấn ; khoảng chừng phân nửa được sản xuất từ tái chế. Đến năm 2008, những nước sản xuất chì đứng vị trí số 1 là Úc, Trung Quốc, Nước Ta, Vương Quốc Anh, Na Uy, Hoa Kỳ, Peru, Canada, Mexico, Thụy Điển, Morocco, Ai Cập, Nam Phi, Hi Lạp, Iceland, Đức, Nước Hàn, Nga, Áo, Phần Lan, Đan Mạch, Israel, Ấn Độ, Ireland, Nhật Bản, Guatemala, Bỉ, Ý, Pháp, Tây Ban Nha, Bồ Đào Nha, Brazil. Trung Quốc và Hoa Kỳ chiếm hơn phân nửa sản lượng nguyên thủy ( không tính tái chế ). [ 15 ]Đến năm 2010, 9,6 triệu tấn chì đã được sản xuất, trong đó 4,1 triệu tấn từ khai thác mỏ. [ 16 ]Với vận tốc sử dụng hiện tại, nguồn đáp ứng chì ước tính sẽ hết sạch trong vòng 42 năm nữa. [ 17 ] Theo nghiên cứu và phân tích của Lester Brown thì ông cho rằng chì hoàn toàn có thể hết sạch trong vòng 18 năm nữa nếu vận tốc sử dụng ngày càng tăng 2 % mỗi năm. [ 18 ] Điều này hoàn toàn có thể cần được xem xét lại khi tính tới sự chăm sóc mới được hồi sinh trong việc tái chế, và tân tiến nhanh trong công nghệ tiên tiến tế bào nguyên vật liệu .
Một mẫu chìSản xuất và tiêu thụ chì đang tăng trên toàn quốc tế. Tổng sản lượng hàng năm vào khoảng chừng 8 triệu tấn ; khoảng chừng phân nửa được sản xuất từ tái chế. Đến năm 2008, những nước sản xuất chì đứng vị trí số 1 là Úc, Trung Quốc, Nước Ta, Vương Quốc Anh, Na Uy, Hoa Kỳ, Peru, Canada, Mexico, Thụy Điển, Morocco, Ai Cập, Nam Phi, Hi Lạp, Iceland, Đức, Nước Hàn, Nga, Áo, Phần Lan, Đan Mạch, Israel, Ấn Độ, Ireland, Nhật Bản, Guatemala, Bỉ, Ý, Pháp, Tây Ban Nha, Bồ Đào Nha, Brazil. Trung Quốc và Hoa Kỳ chiếm hơn phân nửa sản lượng nguyên thủy ( không tính tái chế ). [ 15 ]Đến năm 2010, 9,6 triệu tấn chì đã được sản xuất, trong đó 4,1 triệu tấn từ khai thác mỏ. [ 16 ]Với vận tốc sử dụng hiện tại, nguồn đáp ứng chì ước tính sẽ hết sạch trong vòng 42 năm nữa. [ 17 ] Theo nghiên cứu và phân tích của Lester Brown thì ông cho rằng chì hoàn toàn có thể hết sạch trong vòng 18 năm nữa nếu vận tốc sử dụng ngày càng tăng 2 % mỗi năm. [ 18 ] Điều này hoàn toàn có thể cần được xem xét lại khi tính tới sự chăm sóc mới được hồi sinh trong việc tái chế, và tân tiến nhanh trong công nghệ tiên tiến tế bào nguyên vật liệu .
- Chì là thành phần chính tạo nên ắc quy, sử dụng cho xe.
- Chì được sử dụng như chất nhuộm trắng trong sơn.
- Chì sử dụng như thành phần màu trong tráng men đặc biệt là tạo màu đỏ và vàng.[19]
- Chì dùng làm các tấm ngăn để chống phóng xạ hạt nhân.
- Chì thường được sử dụng trong nhựa PVC[20][21]
Ảnh hưởng đến sức khỏe thể chất.
Chì là một sắt kẽm kim loại độc hoàn toàn có thể gây tổn hại cho hệ thần kinh, đặc biệt quan trọng là ở trẻ nhỏ và hoàn toàn có thể gây ra những chứng rối loạn não và máu. Ngộ độc chì hầu hết từ đường thức ăn hoặc nước uống có nhiễm chì ; nhưng cũng hoàn toàn có thể xảy ra sau khi vô tình nuốt phải những loại đất hoặc bụi nhiễm chì hoặc sơn gốc chì. [ 22 ] Tiếp xúc lâu ngày với chì hoặc những muối của nó hoặc những chất oxy hóa mạnh như PbO2 ) hoàn toàn có thể gây bệnh thận, và những cơn đau không bình thường giống như đau bụng. Đối với phụ nữ mang thai, khi tiếp xúc với chì ở mức cao hoàn toàn có thể bị sẩy thai. Tiếp xúc lâu bền hơn và liên tục với chì làm giảm năng lực sinh sản và sinh dục ở phái mạnh. [ 23 ] Thuốc giải hoặc điều trị nhiễm độc chì là dimercaprol và succimer .
| NFPA 704 “Biểu đồ cháy” |
|---|
 120 120 |
| “Hình thoi cháy” của hạt chì |
Sự chăm sóc đến vai trò của chì trong việc giảm nhận thức ở trẻ nhỏ đã phổ cập thoáng rộng việc giảm sử dụng nó ( tiếp xúc với chì tương quan đến giảm khả năng học ). [ 24 ] Hầu hết những trường hợp hàm lượng chì trong máu cao ở người lớn tương quan đến nơi thao tác. [ 25 ] Hàm lượng chì trong máu cao tương quan với tuổi dậy thì ở bé gái. [ 26 ] Ảnh hưởng của chì cũng làm giảm vĩnh viễn năng lực nhận thức của trẻ nhỏ khi tiếp xúc ở mức cực kỳ thấp. [ 27 ]Trong suốt thế kỷ XX, việc sử dụng chì làm chất tạo màu trong sơn đã giảm mạnh do những mối nguy hại từ ngộ độc chì, đặc biệt quan trọng là ở trẻ nhỏ. [ 28 ] [ 29 ] Vào giữa thập niên 1980, có sự biến hóa đáng kể trong phương pháp chấm hết sử dụng chì. Hầu hết sự đổi khác này là hiệu quả của sự tuân thủ của người tiêu dùng Mỹ với cách quy tắc thiên nhiên và môi trường đã làm giảm đáng kể hoặc loại hẳn việc sử dụng chì trong những loại sản phẩm khác pin như gasoline, sơn, chì hàn, và mạng lưới hệ thống nước. Sử dụng chì đang được Liên minh châu Âu cắt giảm theo thông tư RoHS. Chì vẫn hoàn toàn có thể được tìm thấy với lượng hoàn toàn có thể gây hại trong gốm làm từ cát, vinyl ( sử dụng làm ống và phần cách điện của dây điện ), và đồng được sản xuất tại Trung Quốc. Giữa năm 2006 và 2007, những đồ chơi trẻ nhỏ sản xuất tại Trung Quốc đã bị tịch thu, nguyên do cơ bản là sơn chứa chì được sử dụng để tạo màu cho loại sản phẩm. [ 30 ] [ 31 ]Các muối chì được sử dụng trong men gốm nhiều lúc gây ngộ độc, khi những nước uống có tính acid như nước ép trái cây, đã làm rò rĩ những ion chì ra khỏi men. [ 32 ] Chì ( II ) axetat đã từng được đế quốc La Mã sử dụng để làm cho rượu ngọt hơn, và 1 số ít người xem đây là nguyên do của chứng mất trí của một số ít nhà vua La Mã. [ 33 ]Chì làm ô nhiễm đất cũng là một yếu tố cần chăm sóc, vì chì xuất hiện trong những mỏ tự nhiên và cũng hoàn toàn có thể đi vào đất trải qua sự rò rỉ từ gasoline của những bồn chứa dưới mặt đất hoặc những dòng thảy của sơn chứa chì hoặc từ những nguồn của những ngành công nghiệp sử dụng chì .Chì trong không khí hoàn toàn có thể bị hít vào hoặc ăn sau khi nó và lắng đọng. Nó bị hấp thụ nhanh gọn vào máu và được tin là có tác động ảnh hưởng đến hệ thần kinh TW, tim mạch, thận, và hệ miễn dịch. [ 34 ]
Đặc điểm sinh hóa của ngộ độc chì.
Trong khung hình người, chì ức chế tổng hợp porphobilinogen synthase và ferrochelatase, chống lại sự hình thành cả hai chất porphobilinogen và tích hợp với sắt tạo thành protoporphyrin IX, tiến trình ở đầu cuối trong sự tổng hợp heme. Quá trình này làm cho sự tổng hợp heme không hiệu suất cao và sau đó làm microcytic anemia. [ 35 ] Ở những mức thấp hơn, nó có vai trò tương tự như như calci, can thiệp vào những kênh ion trong quy trình truyền dẫn thần kinh. Đây là một trong những chính sách mà theo đó nó can thiệp vào nhận thức. Nhiễm độc chì cấp tính được chữa trị bằng cách sử dụng dinatri calci edetat : là calci chelat của muối dinatri của acid ethylene-diamine-tetracetic ( EDTA ). Chất này có ái lực lớn với chì hơn là calci và do đó tạo ra chì chelat bằng những trao đổi ion. Chất này sau đó được bài tiết qua đường tiểu, trong khi calci còn lại là vô hại. [ 36 ]
Rò rỉ chì từ những mặt phẳng sắt kẽm kim loại.
Biểu đồ Pourbaix bên dưới cho thấy chì dễ ăn mòn trong thiên nhiên và môi trường citrat hơn trong môi trường tự nhiên không tạo phức. Phần TT của biểu đồ cho thấy rằng sắt kẽm kim loại chì bị oxy hóa thuận tiện trong thiên nhiên và môi trường citrat hơn là trong nước thường thì .
Liên kết ngoài.
Source: http://139.180.218.5
Category: Thuật ngữ đời thường
