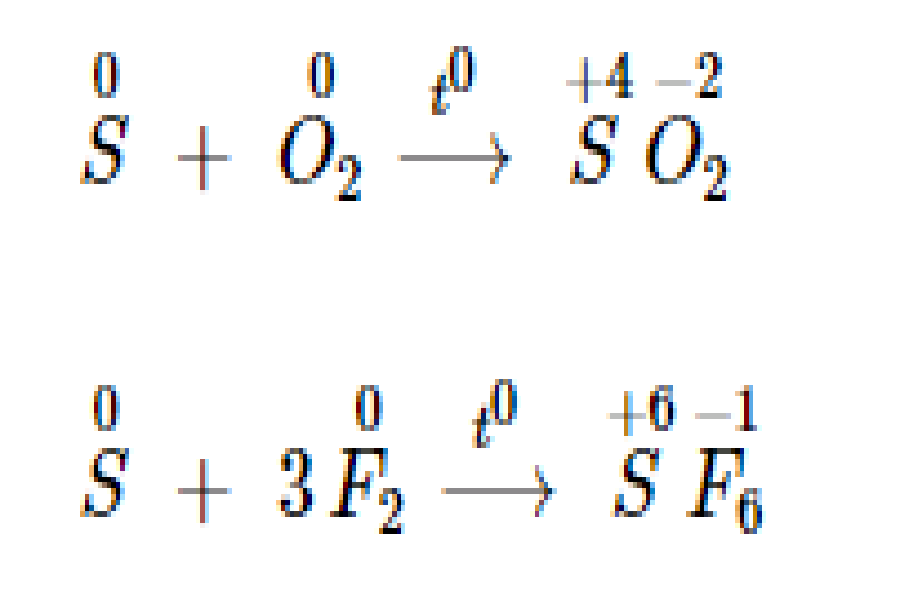Nội dung chính
LƯU HUỲNH LÀ GÌ?
- Lưu huỳnh còn có tên gọi khác là Sulfur, là một nguyên tố hoá học trong bảng tuần hoàn, có ký hiệu là S và có số nguyên tử là 16 .
-
Nguyên tố này là một phi kim phổ biến, không mùi, không vị và có nhiều hoá trị.
- Dạng gốc của phi kim này là chất rắn kết tinh màu vàng chanh .
- Trong tự nhiên, phi kim này hoàn toàn có thể tìm thấy ở dạng đơn chất hoặc trong những khoáng chất sulfua và sulfat .
- Lưu huỳnh được xem là một nguyên tố thiết yếu cho sự sống và chúng được tìm thấy trong 2 axit amin. Trong thương mại, chúng được sử dụng trong phân bón hoặc dùng trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm, ..
- Vị trí : Ô thứ 16, chu kì 3, nhóm VIA
-
Kí hiệu:
32
16
S
1632S
-
Cấu hình e:
1
s2
2
s2
2
p6
3
s2
3
p4
1 s22s22p63s23p4
-
Độ âm điện:
2,58
ĐẶC TRƯNG NỔI BẬT CỦA LƯU HUỲNH
– Ở điều kiện kèm theo nhiệt độ phòng, lưu huỳnh ở trạng thái rắn xốp và có màu vàng nhạt và ở trạng thái đơn chất không có mùi. Phi kim này khi cháy có ngọn lửa màu xanh lam và toả ra đioxit lưu huỳnh có mùi ngột ngạt, khác thường và tạo cảm xúc không dễ chịu. Sulfur không hòa tan trong nước nhưng hòa tan trong đisulfua cacbon và những dung môi không phân cực khác. Một số trạng thái ôxi hóa thông dụng của Sulfur là – 2, – 1 ( pirit sắt … ), + 2, + 4 và + 6. Sulfur tạo thành những hợp chất không thay đổi với gần như mọi nguyên tố, chỉ ngoại trừ những khí trơ .– Ở trạng thái rắn, Sulfur sống sót như những phân tử vòng dạng vòng hoa S8 và cạnh bên đó nó cũng có nhiều hình thù khác. Màu vàng đặc trưng của lưu huỳnh được tạo nên từ việc loại một nguyên tử từ vòng S7. Ngược lại, nguyên tố oxy cùng phân nhóm nhưng lại nhẹ hơn về cơ bản chỉ tổn tại trong 2 dạng là : O2 và O3– Sulfur có tinh thể rất phức tạp, phục thuộc vào những điều kiện kèm theo đơn cử, những thù hình của chúng tạo thành những cấu trúc tinh thể khác nhau, những dạng hình thoi và xiên đơn S8 là những dạng được điều tra và nghiên cứu tỉ mỉ nhất .polymer– Sulfur nóng chảy có độ nhớt, đây cũng là đặc thù điển hình nổi bật của phi kim này, độ nhớt này tăng lên theo nhiệt độ do sự hình thành những chuỗi polyme. Tuy nhiên, sau khi đã đạt được một khoảng chừng nhiệt độ nhất định thì độ nhớt lại bị giảm do đã đủ nguồn năng lượng để phá vỡ chuỗi
– Sulfur vô định hình hay còn gọi là “ dẻo ” hoàn toàn có thể tạo ra khi làm nguội nhanh Sulfur nóng chảy. Theo điều tra và nghiên cứu tinh thể bằng tia X, dạng vô định hình hoàn toàn có thể có cấu trúc xoắn ốc với 8 nguyên tử trên một vòng. Đây là dạng không thay đổi ở nhiệt độ phòng và dần chuyển thành dạng kết tinh. Quá trình này diễn ra trong vài giờ hoặc vài ngày nhưng hoàn toàn có thể tăng cường nếu có xúc tác .
ỨNG DỤNG CỦA LƯU HUỲNH
Ứng dụng chủ yếu của lưu huỳnh
Lưu huỳnh được dùng nhiều trong công nghiệp với những ứng dụng khác nhau. Sulfur có dẫn xuất chính là axít sulfuric ( H2SO4 ), được nhìn nhận là một trong những nguyên tố quan trọng nhất được dùng như nguyên vật liệu công nghiệp và được xem là quan trọng bậc nhất với mọi nghành nghề dịch vụ của kinh tế tài chính quốc tế .Một số ứng dụng đa phần của lưu huỳnh :
-
- axit sulfuricSản xuất
- Sử dụng trong ắc quy, bột giặt, lưu hoá cao su đặc, thuốc diệt nấm và dùng trong sản xuất phân bóng phốtphat .
- Sulfit được sử dụng để làm trắng giấy và làm chất dữ gìn và bảo vệ trong rượu vang và làm khô hoa quả .
- Với thực chất dễ cháy, nó còn được dùng trong những loại diêm, thuốc súng và pháo hoa .
- Sulfat magiê( muối Epsom ) hoàn toàn có thể được dùng như thuốc nhuận tràng, chất bổ trợ cho những bình ngâm ( xử lý hóa học ), tác nhân làm tróc vỏ cây, hay để bổ trợ magiê cho cây cối .
- Lưu huỳnh nóng chảy còn được dùng để tạo những lớp khảm trang trí trong mẫu sản phẩm đồ gỗ .
Vai trò sinh học
-
- Các axít amin cystein và methionin có chứa lưu huỳnh, cũng như mọi polypeptid, protein và enzym có chứa những axít amin này, làm cho lưu huỳnh trở thành thành phần thiết yếu cho mọi tế bào .
- Các link disulfua giữa những polypeptid có vai trò rất quan trọng trong sự tạo ra và cấu trúc của protein. Homocystein và taurin cũng là những axít amin chứa lưu huỳnh nhưng không được mã hóa bởi ADN và cũng không phải là một phần của cấu trúc sơ cấp của những protein .
- Một số dạng vi trùng sử dụng sulfua hiđrô ( H2S ) thay vào vị trí của nước như là chất cung ứng electron trong những tiến trình thô sơ tựa như như quang hợp .
- Thực vật cũng hấp thụ lưu huỳnh từ đất trong dạng những ion sulfat .
- Lưu huỳnh vô cơ tạo thành một phần của những cụm sắt-lưu huỳnh, và lưu huỳnh là chất cầu nối trong vị trí CuA của cytochrom c ôxidaza .
- Sulfur cũng là thành phần quan trọng của coenzym A .
Ảnh hưởng môi trường
-
- Than và dầu mỏ trong công nghiệp khi đốt cháy cùng những xí nghiệp sản xuất điện giải phóng ra lượng lớn đioxit lưu huỳnh SO2, chất này phản ứng với hơi nước và oxy có trong khi quyển tạo ra axít sulfuric tạo nên những cơn mưa axit làm giảm pH của đất, những khu vực nước ngọt, gây phong hoá hoá học với những khu công trình thiết kế xây dựng hoặc kiến trúc .
TÍNH CHẤT CỦA LƯU HUỲNH

Tính chất vật lý
Dạng thù hình :
-
-
Lưu huỳnh tà phương:
S
α
Sα
-
Lưu huỳnh đơn tà:
S
β
Sβ
-
Hai dạng này khác nhau về cấu trúc tinh thể cùng một số ít đặc thù vật lý nhưng có đặc thù hoá học giống nhau. Hai dạng này hoàn toàn có thể đổi khác qua lại với nhau tuỳ theo điều kiện kèm theo nhiệt độ .Ảnh hưởng của nhiệt độ tới đặc thù vật lý :
-
-
Ở nhiệt độ
<
113 độ C
Xem thêm: Đầu số 0127 đổi thành gì? Chuyển đổi đầu số VinaPhone có ý nghĩa gì? – http://139.180.218.5
S
α
và
S
β
là chất rắn màu vàng, phân tử có
8
8
nguyên tử liên kết cộng hóa trị với nhau tạo mạch vòng.
-
Ở nhiệt độ
=
119 độ C
Sα
và
S
β
nóng chảy thành chất lỏng màu vàng, rất linh động.
-
Ở nhiệt độ
=
187 độ C
, lưu huỳnh lỏng trở nên quánh nhớt, có màu nâu đỏ.
-
Ở nhiệt độ
=
445 độ C ,
lưu huỳnh sôi.
-
Tính chất hoá học
Nguyên tử S có 6 e lớp ngoài cùng, trong đó có 2 e độc thân .Trong phản ứng hoá học thì số oxi hóa của lưu huỳnh hoàn toàn có thể giảm hoặc tăng : − 2 ; 0 ; + 4 ; + 6 .
Tính oxi hoá
Khi tính năng với những sắt kẽm kim loại hoặc hidro, số oxi hoá của Sulfur giảm từ 0 xuống – 2 .

Khi tính năng với sắt kẽm kim loại : Sulfur tác tụng với sắt kẽm kim loại tạo thành muối Sunfua .
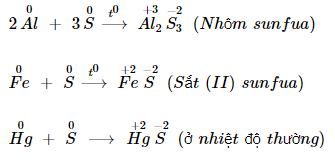
Khi tính năng với hydro tạo thành khí hiđro sunfua .
 Tính khử
Tính khử
Lưu huỳnh tính năng với phi kim hoạt động giải trí mạnh hơn, số oxi hoá tăng lên từ 0 lên + 4 hoặc + 6 .
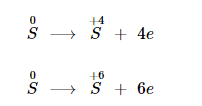
Lưu huỳnh phản ứng với phi kim khi ở nhiệt độ thích hợp .
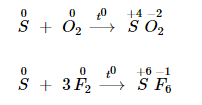
Tác dụng với chất oxi hoá mạnh .
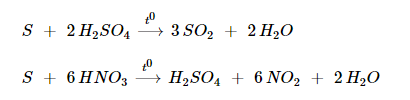
SẢN XUẤT LƯU HUỲNH
Lưu huỳnh được sản xuất đa phần theo 2 chiêu thức sau :
Phương pháp vật lý:
-
- Khai thác dưới dạng tự do trong lòng đất .
- Dùng mạng lưới hệ thống nén nước siêu nóng ( 170 độ C ) cho vào mỏ lưu huỳnh để đẩy lưu huỳnh nóng chảy lên trên mặt đất .
Phương pháp hoá học:
- Đốt H2S trong điều kiện kèm theo thiếu không khí .
![]()
- Dùng H2S khử SO2 .
![]()
LỊCH SỬ HÌNH THÀNH CỦA LƯU HUỲNH
Lưu huỳnh có tên tiếng Phạn là : sulvere và tiếng Latinh là : sulpur, còn được gọi là lưu hoàng, sinh diêm vàng và diêm sinh .Trong tiếng Ả Rập sufra có nghĩa là màu vàng, có từ màu sáng của dạng tự nhiên của lưu huỳnh và được cho rằng nó là nguyên tử của những tên gọi để chỉ lưu huỳnh trong ngôn từ của 1 số ít vương quốc châu Âu lúc bấy giờ .Homer đã đề cập tới “ lưu huỳnh ngăn ngừa những loài phá hoại ” từ thế kỷ 9 TCN và năm 424 TCN thì bộ tộc ở Boeotia đã tiêu hủy những bức tường của thành phố bằng cách đốt hỗn hợp than, lưu huỳnh và hắc ín dưới chân tường .Vào khoảng chừng thế kỷ 12, người Trung Quốc đã ý tưởng ra thuốc súng, là hỗn hợp của nitrat kali ( KNO3 ), cacbon và lưu huỳnh .Năm 1867 lưu huỳnh đã được phát hiện trong những mỏ ở Louisiana và Texas .
SỰ PHỔ BIẾN CỦA LƯU HUỲNH
Ở dạng đơn chất, Sulfur được tìm thấy ở gần những suối nước nóng và những khu vực núi lửa tại nhiều nơi trên quốc tế, đặc biệt quan trọng là dọc theo vành đai lửa Thái Bình Dương .Các mỏ đáng kể của lưu huỳnh đơn chất cũng sống sót trong những mỏ muối dọc theo bờ biển thuộc vịnh Mexico và trong những evaporit ở Đông Âu và Tây Á .Lưu huỳnh thu được từ dầu mỏ, khí đốt và cát dầu Athabasca đã trở thành nguồn cung ứng lớn trên thị trường, với những kho dự trữ lớn dọc theo Alberta .Các hợp chất chứa lưu huỳnh nguồn gốc tự nhiên phổ cập nhất là những sulfua sắt kẽm kim loại, như pyrit ( sulfua sắt ), cinnabar hay chu sa ( sulfua thủy ngân ), galen ( sulfua chì ), sphalerit ( sulfua kẽm ) và stibnit ( sulfua antimon ) cũng như những sulfat sắt kẽm kim loại, như thạch cao ( sulfat canxi ), alunit ( sulfat nhôm kali ) và barit ( sulfat bari ) .
HỢP CHẤT CỦA LƯU HUỲNH
Hợp chất của lưu huỳnh là Sulfua Hydro, có mùi trứng thối đặc trưng, khi hoà tan trong nước thì có tính axit và phản ứng với nhiều sắt kẽm kim loại để tạo ra những sulfua sắt kẽm kim loại .Sulfua sắt kẽm kim loại khá thông dụng, phổ cập nhất là của sắt, sulfua của sắt còn được gọi là pyrit .Lưu huỳnh còn có nhiều hợp chất khác như êtyl và mêtyl mecaptan có mùi khó ngửi và được dùng làm chất tạo mùi cho khí đốt nhằm mục đích thuận tiện phát hiện rò rỉ .Nitrua lưu huỳnh polyme hóa có những đặc thù của sắt kẽm kim loại mặc dầu chúng không chứa bất kể một nguyên tử sắt kẽm kim loại nào. Chúng có những đặc thù điện và quang học không bình thường và polyme này hoàn toàn có thể tạo ra từ têtranitrua têtra lưu huỳnh S4N4 .
Một số hợp chất quan trọng khác của lưu huỳnh
Hợp chất vô cơ
Một số hợp chất vô cơ của lưu huỳnh là :
-
- Sulfua ( S2 – )
- sulfit ( SO32 – ), những muối của axít sulfurơ, H2SO3, axít sulfurơ và những sulfit tương ứng, ion pyrosulfit hay mêtabisulfit ( S2O52 − ) .
- sulfat ( SO42 – ), những muối của axít sulfuric .
- thiôsulfat ( đôi lúc được gọi là thiôsulfit hay “ hyposulfit ” ) ( S2O32 − ) – như thiôsulfat natri .
- Đithiônit natri, Na2S2O4 tạo ra từ axít hyposulfurơ / đithiônơ –
- Đithiônat natri ( Na2S2O6 )
- axít polythiônic ( H2SnO6 )
- Axít perôxymônôsulfuric ( H2SO5 ) và axít perôxyđisulfuric ( H2S2O8 ) –
- polisulfua natri ( Na2Sx )
- Hexaflorua lưu huỳnh, SF6
- Têtranitrua têtra lưu huỳnh S4N4
Hợp chất hữu cơ
Một số hợp chất hữu cơ :
-
- đimêtyl sulfôniôprôpiônat ( DMSP ; ( CH3 ) 2S + CH2CH2COO – )
- thiol ( hay mecaptan )
- thiolat
- Sulfôxít
- Sulfon
- Thuốc thử Lawesson
- Naptalen-1, 8 – điyl 1,3,2,4 – đithiađiphốtphetan 2,4 – đisulfua
Đồng vị
-
- Lưu huỳnh có 18 đồng vị trong đó có 4 đồng vị không thay đổi : S32 ( 95,02 % ), S33 ( 0,75 % ), S34 ( 4,21 % ) và S36 ( 0,02 % ) .
Lưu ý với các hợp chất của lưu huỳnh
Cần cẩn trọng khi tiếp xúc với : đisulfua cacbon, ôxysulfua cacbon, sulfua hiđrô và điôxít lưu huỳnh .
-
-
Đioxit lưu huỳnh an toàn khi sử dụng như phụ gia thực phẩm với 1 lượng nhỏ nhưng ở nồng độ cao độ phản ứng với hơi ẩm để tạo ra axít sulfurơ đủ lớn thì sẽ gây tổn thương cho phổi, mắt và các cơ quan khác.
- Sulfua hiđrô rất độc, độc hơn cả xyanua .
-
Qua bài viết này, Trung Sơn đã chia sẽ đến bạn những điều cần biết về lưu huỳnh cũng như những lưu ý khác về phi kim này. Nếu vẫn còn thắc mắc nào về lưu huỳnh hoặc những vấn đề khác liên quan thì hãy liên hệ ngay với chúng tôi để được giải đáp nhé.
Liên hệ ngay qua Hotline: (028) 3811 9991 để được hỗ trợ – tư vấn nhanh nhất nhé
Source: http://139.180.218.5
Category: Thuật ngữ đời thường